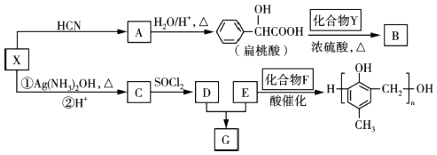
题目内容
【题目】Ⅰ.已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;键能EO=O=499.0 kJ·mol-1则CO(g)+O2(g)CO2(g)+O(g)的ΔH=______kJ·mol-1。
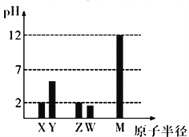
Ⅱ.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。将1.0 mol NO、0.8 mol CO充入2 L恒容密闭容器,分别在T1℃和T2℃下测得n(CO2)随时间(t)的变化曲线如下图所示。

(1)T2℃时,0~2s内的平均反应速率v(N2)= ________。
(2)该反应自发进行的条件(假设ΔH,ΔS不随温度变化而变化)___(高温自发,低温自发,任何温度均不自发,任何温度均自发)。
(3)为使该反应的反应速度增大,且平衡向正反方向移动的是________。
A.及时分离除CO2气体 B.适当升高温度
C.增大CO的浓度 D.选择高效催化剂
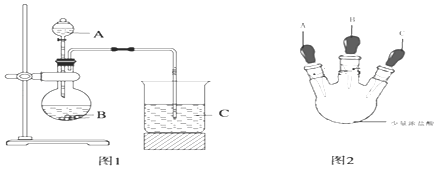
Ⅲ .工业可以采用下列反应合成甲醇:CO(g)+2H2(g) CH3OH(g),在一体积可变的密闭容器中(如图),将2 mol CO和3 mol H2放入容器中,移动活塞至体积为V L,用铆钉固定在A、B点,发生反应,测得在不同条件,不同时段内CO的转化率,得出下列数据。

(1)根据上表数据,比较T1_______T2(选填“>、=、<”);T2温度下,第20 min时,反应达到平衡,该温度下的平衡常数为__________。
(2)T2温度下,第40 min时,拔出铆钉后,活塞没有发生移动,再向容器中通入6 mol的CO,此时V(正)________V(逆) (选填“>、=、<”),判断理由是:___________________。
【答案】 -33.5 0.075mol·L-1·s-1 低温自发 C < V2 < Qc >K,逆动
【解析】本题考查的是盖斯定律和速率和平衡的影响因素以及平衡常数的计算,关键是对题给信息的分析。
Ⅰ.已知:①2CO(g)+O2(g)=2CO2(g) ΔH=-566.0 kJ·mol-1;键能EO=O=499.0 kJ·mol-1,热化学方程式表示为②O2(g)= 2O(g) ΔH=+499.0 kJ·mol-1,则根据盖斯定律分析,有则(①+②)/2即可得热化学方程式CO(g)+O2(g)CO2(g)+O(g) ΔH=-566+499=-33.5kJ·mol-1。
Ⅱ. (1) T2℃时,0~2s内二氧化碳的物质的量的改变量为0.6mol,则根据方程式分析,氮气的改变量为0.3mol,则用氮气表示反应速率为![]() =0.075mol·L-1·s-1 。 (2)该反应在T1温度下先到平衡,说明该温度高,二氧化碳的物质的量小,说明温度升高,平衡逆向移动,则正反应为放热反应,该反应正方向为气体体积减小的方向,所以该反应属于低温自发进行。 (3)A.及时分离除CO2气体,反应速率减小,平衡正向移动,故错误;B.适当升高温度,反应速率增大,平衡逆向移动,故错误;C.增大CO的浓度,反应速率增大,平衡正向移动,故正确;D.选择高效催化剂,反应速率增大,平衡不移动,故错误。故选C。 Ⅲ . (1)从表中数据分析,T2温度下相等时间一氧化碳的转化率高,说明反应速率快,则T2温度高。 (6)
=0.075mol·L-1·s-1 。 (2)该反应在T1温度下先到平衡,说明该温度高,二氧化碳的物质的量小,说明温度升高,平衡逆向移动,则正反应为放热反应,该反应正方向为气体体积减小的方向,所以该反应属于低温自发进行。 (3)A.及时分离除CO2气体,反应速率减小,平衡正向移动,故错误;B.适当升高温度,反应速率增大,平衡逆向移动,故错误;C.增大CO的浓度,反应速率增大,平衡正向移动,故正确;D.选择高效催化剂,反应速率增大,平衡不移动,故错误。故选C。 Ⅲ . (1)从表中数据分析,T2温度下相等时间一氧化碳的转化率高,说明反应速率快,则T2温度高。 (6)
CO(g)+2H2(g) CH3OH(g)
起始物质的量 2 3 0
改变物质的量 2×50% 2×2×50% 2×50%
平衡物质的量 1 1 1
平衡常数为![]() =V2。
=V2。
(2) T2温度下,第40 min时,拔出铆钉后,活塞没有发生移动,说明反应到平衡,此时容器内总物质的量为3mol,容器的体积为vL,再向容器中通入6 mol的CO,则容器的体积变为3VL,此时Qc = 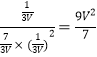 >K,平衡逆向移动,V(正)小于V(逆)。
>K,平衡逆向移动,V(正)小于V(逆)。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】下列关于物质分类的正确组合是( )
物质分类 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
A | Na2CO3 | HNO3 | NaHCO3 | CaO | CO2 |
B | NaOH | HCl | NaCl | Fe3O4 | H2O2 |
C | Fe(OH)3 | HF | CaCO3 | CaO | SO2 |
D | NaOH | CH3COOH | CaF2 | K2O | CO |
A.AB.BC.CD.D