题目内容
(12分)实验室配制一定物质的量浓度的溶液,需经计算、称量、溶解、移液、
洗涤、定容、摇匀、装瓶等步骤。现需配制0.2mol/L的CuSO4溶液500mL。
回答下列问题:
(1)用托盘天平称取CuSO4·5H2O晶体的质量是 g。
(2)将溶解并冷却后的溶液转移的过程中用到的玻璃仪器有 。
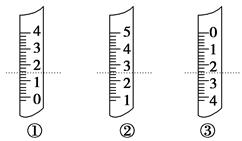
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至 。
(4)下列情况会使所配溶液浓度偏低的是 。(填序号)
A定容时俯视
B未将洗涤烧杯后的溶液转移至容量瓶
C加蒸馏水时,不慎超过了刻度线
D砝码上沾有杂质(或者使用生锈的砝码)
E.容量瓶使用前未经干燥
(每空2分)
⑴25.0;⑵玻璃棒 烧杯 容量瓶;⑶溶液的凹液面与刻度线相切
⑷BC
解析试题分析:(1)500mL 0.2mol/L的硫酸铜溶液中含有溶质硫酸铜的物质的量为:0.2mol/L×0.5L=0.1mol,需要CuSO4?5H2O晶体的质量为:250g/mol×0.1mol=25.0g。
(2)溶解并冷却后的溶液转移的过程中用到的玻璃仪器有:盛放溶液的烧杯、引流作用的玻璃棒和500mL容量瓶,故答案为:玻璃棒、烧杯、容量瓶。
(3)定容时,加水至距刻度线1-2cm时改用胶头滴管滴加蒸馏水至溶液的凹液面与刻度线相切。
(4)A、定容时俯视,导致加入的蒸馏水低于容量瓶刻度线,配制的溶液体积偏小,溶液浓度偏高,故A错误;B、未将洗涤烧杯后的溶液转移至容量瓶,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故B正确; C、加蒸馏水时,不慎超过了刻度线,导致配制的溶液体积偏大,溶液浓度偏低,故C正确;D、砝码上沾有杂质(或者使用生锈的砝码),导致称量的溶质的质量偏大,配制的溶液中溶质的物质的量偏大,配制结果偏高,故D错误;E、容量瓶使用前未经干燥,对溶质的物质的量及溶液的体积都没有影响,所以不影响配制结果,故E错误。
考点:本题考查配制一定物质的量浓度的溶液、误差分析。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案设NA为阿伏伽德罗常数的数值,下列说法中,正确的是
| A.标准状况下,22.4L Cl2完全溶于水时,转移的电子数为NA |
| B.常温下,1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
| C.标准状况下,2.24LNH3中含有的共价键数目为NA |
| D.常温下,23gNO2和N2O4的混合气体中含有NA个氧原子 |
下列有关化学用语表示正确的是
A.比例模型 可以表示水分子,也可以表示二氧化碳分子 可以表示水分子,也可以表示二氧化碳分子 |
B.电子式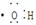 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 |
C.离子结构示意图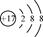 可以表示35Cl-,也可以表示37Cl- 可以表示35Cl-,也可以表示37Cl- |
D.离子方程式HCO3-+H2O H3O+ +CO32-可以表示HCO3-离子的水解,也可以表示它的电离 H3O+ +CO32-可以表示HCO3-离子的水解,也可以表示它的电离 |