题目内容
设NA为阿伏伽德罗常数的数值,下列说法中,正确的是
| A.标准状况下,22.4L Cl2完全溶于水时,转移的电子数为NA |
| B.常温下,1L pH=1的H2SO4溶液中含有H+的数目为0.2NA |
| C.标准状况下,2.24LNH3中含有的共价键数目为NA |
| D.常温下,23gNO2和N2O4的混合气体中含有NA个氧原子 |
D
解析试题分析:氯气溶于水并不是全部和水发生反应,故转移的电子数不到1mol,A错;由于溶液的pH=1,故其1L中含有氢离子0.1mol,B错;标准状况下,2.24L氨气的物质的量为0.1mol,每个氨分子中含有3个氮氢键,故共价键数目为0.3NA,C错;二氧化氮和四氧化二氮的最简式相同,其23g相当于二氧化氮0.5mol,其中含氧原子1mol,D对。
考点:考查了阿伏伽德罗常数知识。

练习册系列答案
相关题目
下列有关化学用语表述正确的是
A.原子结构示意图 可以表示35C1,也可以表示37C1 可以表示35C1,也可以表示37C1 |
| B.在标准状况下,纯水的pH=7 |
C.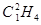 和 和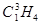 是同分异构体 是同分异构体 |
| D.葡萄糖的结构简式为C6H12O6 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.16g CH3OH中含有2nA个共价键 |
| B.1 mol?L-1CuCl2溶液含有2nA个Cl- |
| C.1 mol Fe与足量的C12反应,转移3nA个电子 |
| D.常温常压下,22.4L CH4中含有nA个CH4分子 |
以NA表示阿伏加德罗常数,下列说法中正确的是
| A.在标准状况下,含4molHCl的浓盐酸与足量的MnO2反应可生成22.4L氯气 |
| B.0.1mol·L-1氯化钡溶液中Cl-数是0.2NA |
| C.18gD2O所含电子数目为10NA(相对原子质量:O-16) |
| D.4g氦气所含分子数为NA(相对原子质量:He-4) |
用NA表示阿伏加德罗常数的值。下列叙述正确的是
| A.常温下,18g H2O中含H2数目为NA |
| B.标准状况下,22. 4LH2O中含有化学键的数目为2NA |
| C.将0.5mol SO2通入足量水中,充分反应后可得到H2 SO3分子数为0.5NA |
| D.常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移电子的数目为0.4 NA |
下列化学用语表示正确的是 ( )
| A.HClO的结构式:H—O—Cl |
B.四氯化碳的电子式: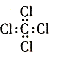 |
C.CO2的比例模型: |
| D.乙烯的结构简式:CH2CH2 |
下列化学用语正确的是
A.亚硫酸氢钠溶液显酸性的原因是:HSO3-+H2O H3O++SO32- H3O++SO32- |
B.氯化铵的电子式为: |
C.钠离子的离子结构示意图为:Na  |
D.水分子比例模型为: |
用浓硫酸配制一定物质的量浓度的硫酸溶液,下列操作会造成所配溶液浓度偏高的是( )
| A.溶解后的溶液未冷却至室温就转移入容量瓶中 |
| B.反复倒转摇匀后,液面低于刻度线,再加蒸馏水至液面最低点恰好与刻度线相平 |
| C.洗涤烧杯和玻璃棒的溶液转移入容量瓶中 |
| D.定容时,眼睛仰视刻度线 |