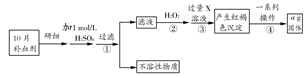
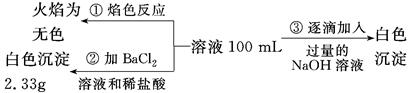
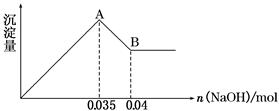
题目内容
已知一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
(1)原NaOH溶液的质量分数为 ;
(2)所得溶液中Cl-的物质的量为 mol;
(3)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
(1)10.7%。 (2)0.25。 (3)3︰2。
解析试题分析:(1)n(NaOH)=0.1L×3.00 mol/L=0.3mol。m(NaOH)= 0.3mol×40g/mol=12g.m(溶液)=ρ·V=1.12 g/mL×100 mL=112g.所以原NaOH溶液的质量分数为12g÷112g×100%=10.7%。(2)在反应后的溶液中Na元素的存在方式为NaCl、NaClO。根据Na、Cl元素守恒可得所得溶液中Cl-的物质的量为0.3mol-0.0500 mol=0.25mol.(3)由方程式 NaOH+HCl=NaCl+H2O ;Cl2+2NaOH=NaCl+NaClO+H2O.可知与NaOH反应消耗的氯气的物质的量为0.0500 mol,同时产生NaCl0.0500 mol。则HCl反应产生的NaCl的物质的量为0.25mol-0.0500 mol=0.20mol.因此发生反应H2+Cl2 2HCl的H2与Cl2的物质的量都为0.10mol.所以n(H2)=0.1mol;n(Cl2)(总)= 0.1mol+0.0500 mol=0.15mol.故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2。
2HCl的H2与Cl2的物质的量都为0.10mol.所以n(H2)=0.1mol;n(Cl2)(总)= 0.1mol+0.0500 mol=0.15mol.故所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)=0.15mol:0.1mol=3:2。
考点:考查溶液的质量分数表示与物质的量浓度表示的换算、一定量的氢气与氯气的反应产物与NaOH溶液反应的情况的知识。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案下列化学用语表示正确的是 ( )
| A.HClO的结构式:H—O—Cl |
B.四氯化碳的电子式: |
C.CO2的比例模型: |
| D.乙烯的结构简式:CH2CH2 |
铁、铝各1mol组成的混合物溶于一定量的盐酸,恰好完全反应后,再加入3mol Na2O2固体使之充分反应,最终产物是( )
| A.Fe(OH)2、Al(OH)3、NaCl |
| B.Fe(OH)2、Al(OH)3、NaAlO2、NaCl |
| C.Fe(OH)3、NaAlO2、NaCl |
| D.Fe(OH)3、Al(OH)3、NaAlO2、NaCl |

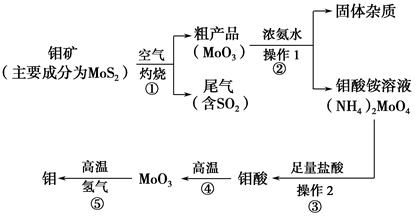
 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O