题目内容
【题目】实验测得1mol H2与1mol Cl2反应生成2mol HCl时,放出184.6kJ的热量,其理论分析数据与实验数据略有差异,如图表示上述反应能量变化的理论分析示意图:
(1)化学键断裂需要(填“释放”或“吸收”)能量;
(2)图中表示了吸收和释放的能量,其中释放的能量共kJ;
(3)该反应的反应物的总能量(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是(填“放热”或“吸热”)反应;
(4)用图示数据计算其反应热,写出该反应的热化学方程式 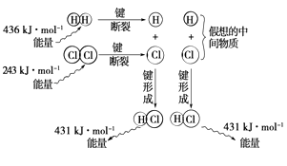
【答案】
(1)吸收
(2)862
(3)大于;放热
(4)H2(g)+Cl2(g)═2HCl(g)△H=﹣183kJ/mol
【解析】解:(1)化学键断裂需要吸收能量,所以答案是:吸收;(2)形成化学键放出热量:2×431kJ=862kJ,所以答案是:862;(3)该反应中反应物的总能量大于生成物的总能量,属于放热反应,所以答案是:大于;放热;(4)化学键断裂吸收热量:436kJ+243kJ=679kJ,
形成化学键放出热量:2×431kJ=862kJ,
热化学方程式是:H2(g)+Cl2(g)═2HCl(g)△H=(436kJ/mol+243kJ/mol)﹣2×431kJ/mol=﹣183kJ/mol,
所以答案是:H2(g)+Cl2(g)═2HCl(g)△H=183kJ/mol.
【考点精析】掌握反应热和焓变是解答本题的根本,需要知道在化学反应中放出或吸收的热量,通常叫反应热.

练习册系列答案
相关题目