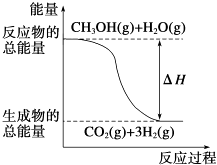
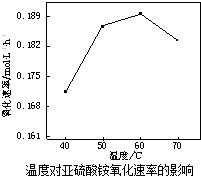
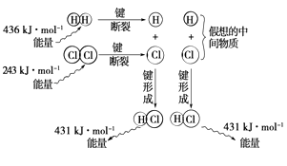
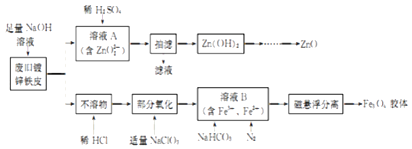
题目内容
【题目】将0.84 g NaHCO3和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
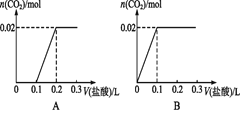
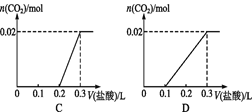
A. A B. B C. C D. D
【答案】D
【解析】0.84gNaHCO3的物质的量为0.01mol,1.06gNa2CO3的物质的量为0.01mol;二者混合后,溶液中含有0.01molHCO3-和0.01molCO32-,滴加盐酸,CO32-先与H+反应:CO32-+H+=HCO3-,不放出气体,消耗0.01molH+即0.1L盐酸;此时溶液中含有0.02molHCO3-,继续滴加盐酸,HCO3-与H+反应发生反应:HCO3-+H+=H2O+CO2↑,有气体产生,0.02molHCO3-完全反应消耗盐酸0.2L,即滴加盐酸至0.3L时产生CO2达到最大值。故选D。

练习册系列答案
相关题目