��Ŀ����
����Ŀ��ʵ������NaClO3��Na2SO3��ȡClO2���壬����ClO2��ǿ�����������������H2O2��Ӧ�Ƶ�Ư��NaClO2��װ����ͼ1��ʾ���� 
��֪����ͼ2������I��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO33H2O������38��ʱ����������NaClO2������30% H2O2����40��ʱ����ȫ�ֽ⣻������60��ʱNaClO2�ֽ��NaClO3��NaCl��
��1��ͼ1װ��A�����ķ�Ӧ�У���ԭ���� ��
��2��ͼ1װ��B�з�Ӧ����NaClO2�Ļ�ѧ����ʽΪ �� ��ʵ����ͼ1װ��B������¶ȿ��Ʋ�����40�棬�ڲ��ı�NaOH��ҺŨ�Ⱥ�����������£��ɲ�ȡ�Ĵ�ʩ���� ��
��3���벹���ͼ1װ��B��Ӧ�����Һ�л��NaClO2����IJ������裮 ����55�� ʱ�����ᾧ���������������õ���Ʒ��
��4��ͼ1װ��C�������� ��
��5��֤��ʵ���ͼ1װ��B���û����Һ�е�NaClO2���������Ե�ʵ�鷽���� �� ���ɹ�ѡ�õ��Լ���ϡH2SO4��FeCl2��Һ��KSCN��Һ��
���𰸡�
��1��Na2SO3
��2��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2�������μ����ᡢH2O2��װ��B����ˮԡ��
��3�����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60�����
��4����ֹD�е���Һ������Bƿ����ȫƿ����
��5�������Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2����������
����������1��Aװ�õķ�ӦΪ2NaClO3+Na2SO3+H2SO4=2ClO2��+2Na2SO4+H2O��Na2SO3����Ԫ�ػ��ϼ����ߣ�������������ԭ�������Դ��ǣ�Na2SO3����2����Bװ��ΪClO2��ǿ�����������������H2O2��Ӧ�Ƶ�Ư��NaClO2 �� ��ѧ����ʽΪ��2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2��
���Դ��ǣ�2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2����ʵ����ͼ1װ��B������¶ȿ��Ʋ�����40�棬�ڲ��ı�NaOH��ҺŨ�Ⱥ�����������£��ɲ�ȡ�Ĵ�ʩ�л����μ����ᡢH2O2��װ��B����ˮԡ�ȣ�
���Դ��ǣ������μ����ᡢH2O2��װ��B����ˮԡ�ȣ���3����֪��NaClO2������Һ���¶ȵ���38��ʱ�����ľ�����NaClO33H2O������38��ʱ����������NaClO2 �� ����60��ʱNaClO2�ֽ��NaClO3��NaCl����ͼ1װ��B��Ӧ�����Һ�л��NaClO2����IJ�������Ϊ����55��ʱ�����ᾧ�����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60�����õ���Ʒ��
���Դ��ǣ����ȣ�������38�棩���ˣ���38��60����ˮϴ�ӣ�����60������4��Cװ��Ϊ��ȫƿ����ֹD�е���Һ������Bƿ�У�
���Դ��ǣ���ֹD�е���Һ������Bƿ����ȫƿ���У���5��װ��B���û����Һ�е�NaClO2����H2O2 �� ��֤NaClO2���������ԣ����Ƚ�H2O2��ȥ�������������Ӽ��飬ʵ�鷽���ǣ�װ��B���û����Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2���������ԣ�
���Դ��ǣ������Һ������40����60��֮���ȥH2O2 �� ��ȴ���ټ���FeCl2��Һ�뼸��KSCN��Һ����Һ��Ѫ��ɫ��֤��NaClO2���������ԣ�

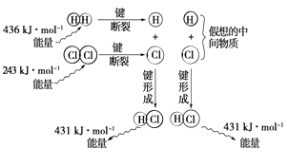
����Ŀ����֪25���101kPaʱ
��CO��g��+ ![]() O2��g���TCO2��g����H1=��a kJ/mol
O2��g���TCO2��g����H1=��a kJ/mol
��H2��g��+ ![]() O2��g���TH2O��l����H2=��b kJ/mol
O2��g���TH2O��l����H2=��b kJ/mol
��C2H5OH��l��+3O2��g���T2CO2��g��+3H2O��l����H3=��c kJ/mol
��1���Լ���2CO��g��+4H2��g���TH2O��l��+C2H5OH��l���ġ�H= ��
��2���Է�ӦN2O4��g��2NO2��g����H��0�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯������ͼ��ʾ������˵�� ����ȷ����________
A.A��C����ķ�Ӧ���ʣ�A��C
B.B��C����������ƽ����Է���������B��C
C.A��C�����������ɫ��A�Cdz
D.��״̬A��״̬B�������ý��µķ���
��3����100��ʱ����0.50mol��NO2�������2L��յ��ܱ������У�ÿ��һ��ʱ��ͶԸ������ڵ����ʽ��з������õ�������ݣ�
ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
n��NO2��/mol | 0.50 | n1 | 0.34 | n3 | n4 |
n��N2O4��/mol | 0.00 | 0.05 | n2 | 0.10 | 0.10 |
�����������£�ǰ20�����������ƽ����Ӧ����Ϊ ��ƽ��ʱ����������ת����Ϊ ��
�ڸ��¶��£���Ӧ��ƽ�ⳣ��KֵΪ ��������һλС����
��4���״���������ȼ�ϵ�أ������ΪKOH��Һ���õ��㷺Ӧ�ã���д����ȼ�ϵ�ظ����ĵ缫��Ӧʽ ����ͨ�����֮ǰ�����KOH��Һ��Ũ��Ϊ0.6mol/L�����Ϊ100mL��������ת��0.15mol��������Һ��pHΪ ����������ֲ��䣬����������
��5�������ָ�����������Һ������ƽ��ʱ���ѵ���ĵ���ʷ�����ռԭ���ܷ������İٷ������������£�c mol/L��ˮ�ĵ���ƽ�ⳣ��ΪKb �� ��ð�ˮ�ĵ���� ��= ��������c��Kb��ʾ���ɽ��н��Ƽ��㣩