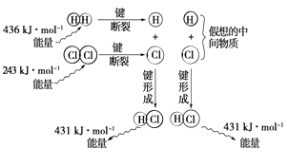
题目内容
【题目】下列说法中不正确的是
A. 金属的冶炼原理,就是在一定条件下将金属从其化合物中还原出来
B. 将少量Na放入硫酸铜溶液中,可生成金属铜
C. 将废铁屑加入FeCl2溶液中,可用于除去工业废气中的Cl2
D. 铝合金可大量用于高铁建设
【答案】B
【解析】
A. 金属的冶炼原理,就是在一定条件下将金属从其化合物中还原出来,故A正确;
B. 将少量Na放入硫酸铜溶液中,钠会和水反应生成NaOH,而不是和铜离子发生置换反应,故B错误;
C. 氯气会将氯化亚铁氧化为氯化铁,而铁屑又可将三价铁离子还原为亚铁离子,继续和氯气反应,故C正确;
D. 铝合金密度小硬度大,可大量用于高铁建设,故D正确;
故答案选B。

 口算题天天练系列答案
口算题天天练系列答案【题目】下列示意图与对应的反应情况正确的是
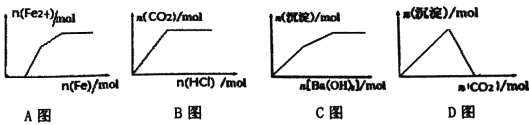
A. Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉
B. Na2CO3、NaHCO3溶液中逐滴加入HCl
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
D. NaAlO2溶液中逐渐通入CO2
【答案】A
【解析】A.Fe(NO3)3、Cu(NO3)2、HNO3混合溶液中逐渐加入铁粉,铁粉先和稀硝酸完全反应生成Fe(NO3)3,继续加入铁粉,将溶液里的Fe(NO3)3全部还原为Fe(NO3)2,最后与Cu(NO3)2反应生成Cu和Fe(NO3)2,故A正确;B.Na2CO3、NaHCO3溶液中逐滴加入稀HCl,先与Na2CO3反应生成NaHCO3,完全反应后继续滴加稀盐酸,NaHCO3与稀HCl反应生成CO2气体,故B错误;C.假设n(KAl(SO4)2)=2mol,则n(Al3+)=2mol,n(SO42-)=4mol,当加入n(Ba(OH)2)=3mol时,Al3+完全沉淀生成2mol Al(OH)3,此时SO42-剩余1mol,继续加入1mol Ba(OH)2,此时发生的反应为Ba2++SO42-═BaSO4、Al(OH)3+OH-═AlO2-+2H2O,生成1molBaSO4沉淀,同时有2molAl(OH)3溶解,因此沉淀的物质的量减少,最后保持不变,根据分析可知图象应该只有一段上升的过程,故C错误;D.NaAlO2溶液中通入CO2,开始出现沉淀,当CO2过量时沉淀不溶解为定值,故D错误;故答案为A。
【题型】单选题
【结束】
16
【题目】下列实验中,对应的现象及结论都正确且两者具有因果关系的是
选项 | 实验 | 现象 | 结论 |
A | 向FeSO4溶液中滴加HNO3酸化的H2O2 | 溶液由浅绿色变为黄色 | 氧化性: H2O2>Fe3+ |
B | 将铜粉加入lmol/LFe2(SO4)3溶液中 | 溶液变蓝、有黑色固体出现 | 活泼性: Fe>Cu |
C | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热 | 金属熔化,液态铝不滴落下来 | 熔点: A12O3>A1 |
D | 向饱和NaHCO3溶液中滴加浓盐酸,再将产生的气体通入NaAlO2溶液 | NaAlO2 溶液变浑蚀 | 酸性: HCl>H2CO3>Al(OH)3 |
A. A B. B C. C D. D
【题目】在一定温度下,将气体X和气体Y 各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表,下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率v(Z)=2.0×10﹣3 mol/(Lmin)
B.其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C.该温度下此反应的平衡常数K=1.44
D.其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大