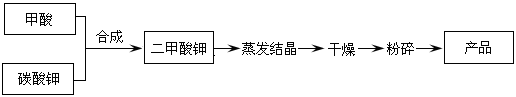
题目内容
用质量分数为98%,密度为1.84g·cm-3的浓硫酸配制l mol/L稀硫酸100mL,其操作有以下各步:
①用量筒量取 mL浓硫酸
②洗涤烧杯和玻璃棒2-3次,将洗涤液转入容量瓶中
③将稀释、冷却后的硫酸转入100 mL容量瓶中
④将浓硫酸倒入盛有水的烧杯中稀释、冷却
⑤加水至液面接近刻度线1~2cm处,定容,摇匀
完成下列填空:
(1)第①步操作中应用量筒量取 mL浓硫酸;应选择 mL量筒(填5、10或50)。
(2)本实验用到的基本仪器已有烧杯、量筒、玻璃棒,还缺少的仪器是 。
(3)正确的操作顺序是(用序号填写) 。
(4)下列操作会使实际浓度偏高,偏低还是不变,请填写:
1).摇匀后,液面低于刻度线,没有再加水;
2).移液过程中,不小心溅出少量溶液;
3).定容时,如果俯视刻度线,配制的硫酸浓度将
(1)5.4mL; 10 (各1分) (2)100mL容量瓶、胶头滴管 (各1分)
(3)①④③②⑤ (2分) (4)不变 偏低 偏高 (3分)
解析试题分析:(1)浓H2SO4的物质的量浓度c=1000×1.84×98%÷98mol/L=18.4mol/L.根据稀释定律,稀释前后溶质的物质的量不变,来计算浓硫酸的体积,设浓硫酸的体积为xmL,所以xmL×18.4mol/L=100mL×1mol/L,解得:x≈5.4,所需浓硫酸的体积为5.4mL.量筒规格越接近所需浓硫酸体积误差越小,所以选择10mL量筒。
(2)由提供的仪器可知还需要仪器有:100mL容量瓶、胶头滴管。
(3)操作步骤有计算、量取、稀释、移液、洗涤移液、定容、摇匀等操作,所以正确的操作顺序是①④③⑤②。
(4)1)操作正确,实际浓度不变。
2)移液过程中,不小心溅出少量溶液,溶质减少,实际浓度偏低。
3)定容时,如果俯视刻度线,导致所配溶液的体积减小,配制的硫酸浓度将偏高。
考点:本题考查一定物质的量浓度溶液的配置、相关计算及误差分析。

实验室中需要配制500 mL 0.10 mol·L-1的NaOH溶液,就该实验回答下列问题。
(1)用托盘天平称量NaOH固态 g。称量NaOH固体需注意以下两个问题:①因为NaOH具有腐蚀性,所以称量时,应选用 盛装NaOH固体;②称量必须迅速,目的是防止 。
(2)实验所需要的仪器除托盘天平、药匙外,还需要的玻璃仪器有: 、 、 、 。
(3)下列操作对所配制的溶液浓度没有影响的是 。
| A.定容时仰视刻度线 |
| B.将烧杯中溶解后的溶液立刻注入容量瓶,然后再添加蒸馏水至刻度线 |
| C.摇匀定容后,用胶头滴管向容量瓶中滴加蒸馏水至刻度线 |
| D.配制溶液前用蒸馏水润洗容量瓶 |
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
| 盐酸 分子式:HCl 相对分子质量:36.5,密度:1.19 g·cm-3 HCl的质量分数:36.5% |
(1)该浓盐酸中HCl的物质的量浓度为__ ____mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.400 mol·L-1的稀盐酸。
①该学生需要量取___ _____mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面 ( )
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水 ( )
(4)①假设该同学成功配制了0.400 mol·L-1的盐酸,他又用该盐酸中和含0.4 g NaOH的NaOH溶液,则该同学需取________mL盐酸。(精确到小数点后一位)
②假设该同学用新配制的盐酸中和含0.4 g NaOH的NaOH溶液,发现比①中所求体积偏小,则可能的原因是________。
A.浓盐酸挥发,浓度不足
B.配制溶液时,未洗涤烧杯
C.配制溶液时,俯视容量瓶刻度线
D.加水时超过刻度线,用胶头滴管吸出
 H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。
H2(g)+1/2S2(g) 在恒容密闭容器中,控制不同温度进行H2S的分解实验:以H2S的起始浓度均为c mol·L-1测定H2S的转化率,结果如右下图所示。图中a为H2S的平衡转化率与温度关系曲线,b曲线表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则反应速率v(H2)= (用含c、t的代数式表示)。请说明随温度的升高,曲线b向曲线a逼近的原因: 。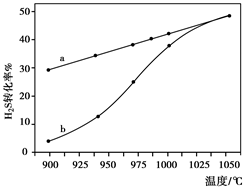
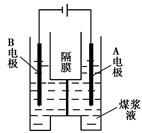

 CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
CO2+2H2O+4Cu。当CH4完全反应后,硬质玻璃管的质量减轻4.8克。将该反应后产生的气体通过过量澄清石灰水中,充分吸收,生成沉淀8.5克。
 2Fe(s) +3CO(g);
2Fe(s) +3CO(g);