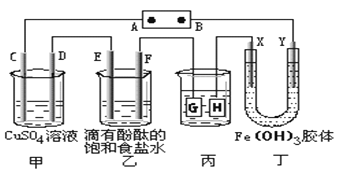
题目内容
【题目】25℃时,用浓度为0.1000mol·L-1的NaOH溶液滴定20.00mL浓度为0.1000mo l·L-1的某酸HX,滴定曲线如图所示。下列说法正确的是( )

A. HX的电离常数Ka的数量级为10-10
B. P点溶液中微粒浓度大小为:c(Na+)>c(HX)>c(X-)>c(OH-)>c(H+)
C. 滴定过程中可选用的指示剂有甲基橙和酚酞
D. A点到B点过程中,水电离出的c(H+)×c(OH-)先增大,后不变
【答案】A
【解析】分析:A项,根据A点pH和电离平衡常数表达式计算;B项,确定P点溶液由等物质的量浓度的NaX和HX组成的混合液,溶液呈碱性说明X-的水解程度大于HX电离程度;C项,强碱与弱酸完全反应后的溶液呈碱性,选择酚酞作指示剂;D项,酸、碱对水的电离起抑制作用,可水解的盐对水的电离起促进作用。
详解:A项,0.1000mol/LHX溶液的pH=5.15,溶液中c(H+)=c(X-)=10-5.15,c(HX)=(0.1000-10-5.15)mol/L![]() 0.1000mol/L,HX的电离方程式为HX
0.1000mol/L,HX的电离方程式为HX![]() H++X-,HX的电离常数Ka=
H++X-,HX的电离常数Ka=![]() =
=![]() =10-9.3=100.7
=10-9.3=100.7![]() 10-10,Ka的数量级为10-10,A项正确;B项,P点加入10mLNaOH溶液,0.1000mol/L10mLNaOH溶液与0.1000mol/L20.00mLHX充分反应得到等物质的量浓度的NaX和HX的混合液,溶液的pH=8说明X-的水解程度大于HX的电离程度,P点溶液中微粒浓度由大到小的顺序为:c(HX)
10-10,Ka的数量级为10-10,A项正确;B项,P点加入10mLNaOH溶液,0.1000mol/L10mLNaOH溶液与0.1000mol/L20.00mLHX充分反应得到等物质的量浓度的NaX和HX的混合液,溶液的pH=8说明X-的水解程度大于HX的电离程度,P点溶液中微粒浓度由大到小的顺序为:c(HX)![]() c(Na+)
c(Na+)![]() c(X-)
c(X-)![]() c(OH-)
c(OH-)![]() c(H+),B项错误;C项,NaOH与HX恰好完全反应得到的NaX溶液呈碱性,应选用碱性范围内发生颜色变化的指示剂,滴定过程中选用的指示剂为酚酞,C项错误;D项,A点HX电离的H+抑制水的电离,随着NaOH溶液的滴入,HX不断被消耗生成NaX,HX电离的H+对水的电离的抑制程度减小,X- 水解对水的电离的促进程度增大,当加入20mLNaOH溶液时NaOH和HX恰好完全反应,水的电离程度达最大,NaOH溶液大于20mL时过量的NaOH电离的OH- 抑制水的电离,A点到B点过程中,水电离的c(H+)
c(H+),B项错误;C项,NaOH与HX恰好完全反应得到的NaX溶液呈碱性,应选用碱性范围内发生颜色变化的指示剂,滴定过程中选用的指示剂为酚酞,C项错误;D项,A点HX电离的H+抑制水的电离,随着NaOH溶液的滴入,HX不断被消耗生成NaX,HX电离的H+对水的电离的抑制程度减小,X- 水解对水的电离的促进程度增大,当加入20mLNaOH溶液时NaOH和HX恰好完全反应,水的电离程度达最大,NaOH溶液大于20mL时过量的NaOH电离的OH- 抑制水的电离,A点到B点过程中,水电离的c(H+)![]() c(OH-)先增大后减小,D项错误;答案选A。
c(OH-)先增大后减小,D项错误;答案选A。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。已知:还原性SCN->Cl-
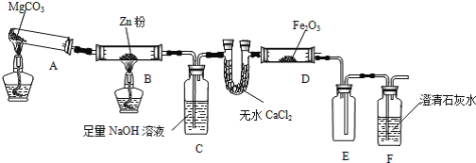
(1)装置B中发生的化学方程式____________。 装置 C 的作用是_________。 用酒精喷灯对装置D加热,得到灰黑色粉末。用黑色粉末进行以下实验:
步骤 | 操作 | 现象 |
1 | 取灰黑色粉末加入稀硫酸 | 溶解,有气泡 |
2 | 取步骤 1 中溶液,滴加 NaOH 溶液后,在空气中,搅拌放置 | 白色沉淀 最终变为红褐色 |
3 | 取步骤 1 中溶液,滴加 KSCN 溶液 | 无现象 |
4 | 向步骤 3 溶液中滴加新制氯水至过量 | 先变红,后褪色 |
(2)得到的灰黑色粉末是__________________(填写化学式)。
(3)步骤2 中“白色沉淀最终变为红褐色”的化学反应方程式为____________。
(4)步骤4 中,溶液变红的原因为 ;溶液褪色可能的原因_________ 。验证上述原因的实验操作方法为____________。
(5)上述装置,从实验安全考虑,需要采取的改进措施是_____________。