题目内容
5.下列各组中的性质比较,正确的是( )| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO>H2SO3>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br->I- |
分析 A、元素的非金属性越强,对应氢化物的稳定性越强;
B、元素的非金属性越强,最高价氧化物对应水化物的酸性越强;
C、同周期元素的原子从左到右,最高价氧化物对应水化物的碱性逐渐减弱,主族元素的原子从上到下,最高价氧化物对应水化物的碱性逐渐增强;
D、卤族元素,从上到下对应阴离子的还原性逐渐增强:F-<Cl-<Br-<I-.
解答 解:A、元素的非金属性:N>P>Si,所以氢化物的稳定性:NH3>PH3>SiH4,故A错误;
B、元素的非金属性越强,最高价氧化物对应水化物的酸性越强,HClO和H2SO3不是最高价含氧酸,它属于弱酸,三者的酸性::H2SO3>H3PO4>HClO,故B错误;
C、同周期元素的原子从左到右,最高价氧化物对应水化物的碱性逐渐减弱,主族元素的原子从上到下,最高价氧化物对应水化物的碱性逐渐增强,所以碱性:碱性:KOH>NaOH>Mg(OH)2,故C正确;
D、卤族元素,从上到下对应阴离子的还原性逐渐增强:F-<Cl-<Br-<I-,故D错误;
故选C.
点评 本题考查元素周期律的递变规律,注意把握元素的性质与对应单质、化合物的性质的关系,题目难度不大,学习中注意积累,侧重微粒性质比较的考查.

练习册系列答案
相关题目
15.下列有机分子中所有碳原子一定处于同一平面的是( )
| A. | 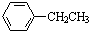 | B. | HC≡C-CH2CH3 | C. | 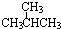 | D. | 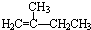 |
16.下列说法正确的是( )
| A. | 极性分子中一定没有非极性键 | B. | 非极性分子中一定不含极性键 | ||
| C. | 单质分子中一定存在非极性键 | D. | 极性分子中一定有极性键 |
20.食品香精菠萝酯的生产路线(反应条件略去)如下,下列叙述正确是( )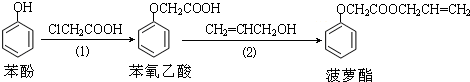
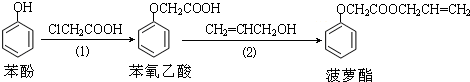
| A. | 可用FeCl3溶液检验步骤(1)产物的是否有苯酚残留 | |
| B. | 可用溴水检验步骤(2)产物中是否有烯丙醇残留 | |
| C. | 苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| D. | 苯氧乙酸和菠萝酯均可与溴水发生反应 |
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为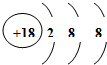 ;
;
(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式 ;
;
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑥ | ② | |||||
| 三 | ③ | ⑤ | ④ | ⑩ | ⑦ | ⑧ | ||
| 四 | ⑨ |
 ;
;(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式
 ;
;(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
17.下列每组中的两对物质,都能用分液漏斗分离且水层能从分液漏斗的下口放出( )
| A. | 蔗糖和水、汽油和水 | B. | 酒精和水 苯和水 | ||
| C. | 食用油和水、汽油和水 | D. | 食用油和水、四氯化碳和水 |
14.下列关于实验操作的陈述中正确的是( )
| A. | 受热后的蒸发皿要用坩埚钳夹取,并放在石棉网上冷却 | |
| B. | 稀释浓硫酸时,应在量筒中先加入一定量水,再沿器壁缓慢注入浓硫酸,并用玻璃棒搅拌 | |
| C. | 过滤时,为了加速溶液透过滤纸,可以用玻璃棒末端轻轻搅拌滤纸上的混合物 | |
| D. | 不慎将桌面上的酒精灯打翻引起小面积着火时,应迅速用水扑灭火 |
15.下列说法正确的是( )
| A. | 需要0.2molNaOH固体,在托盘天平上称量时,砝码加上游码的质量等于0.8g | |
| B. | 配制一定物质的量浓度的NaCl溶液,定容时仰视凹液体,会导致溶液的浓度偏低 | |
| C. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| D. | AgCl难溶于水,在水中导电性较差,所以AgCl是非电解质 |