题目内容
【题目】设NA表示阿伏加德罗常数的值,下列有关叙述正确的是
A.标准状况下,22.4L已烷含有的共价键总数为19NA
B.16 g O2和14C2H4的混合物中所含中子数为8NA
C.1 L 0.1 mol·L-1 Na2CO3溶液中阴阳离子数之和为0.3NA
D.密闭容器中1.5 mol H2与0.5 mol N2充分反应,得到NH4的分子数为NA
【答案】B
【解析】
A.己烷在标准状况下为液态,22.4L已烷的物质的量未知,A错误;
B. O2和14C2H4均含有16个中子,两者的相对分子质量均为32g/mol,16 g O2和14C2H4的混合物的物质的量为![]() ,则该混合物中所含的中子数为
,则该混合物中所含的中子数为![]() ,B正确;
,B正确;
C. CO32-在溶液中存在水解,Na2CO3溶液中存在的离子有CO32-、HCO3-、OH-、H+、Na+,则1 L 0.1 mol·L-1 Na2CO3溶液中阴阳离子数之和大于0.3NA,C错误;
D.该反应为可逆反应,不能完全反应,故得到NH4的分子数小于NA,D错误;
答案选B。

【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。试回答下列问题:
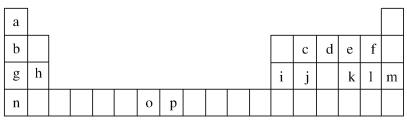
(1)元素p为26号元素,请写出其基态原子的电子排布式________________。
(2)d与a反应的产物的分子,空间构型为_________________。
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:________________________________________。
(4)o、p两元素的部分电离能数据列于下表:
元素 | o | p | |
电离能/ (kJ·mol-1) | I1 | 717 | 759 |
I2 | 1 509 | 1 561 | |
I3 | 3 248 | 2 957 | |
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难。对此,你的解释是___________________________________。
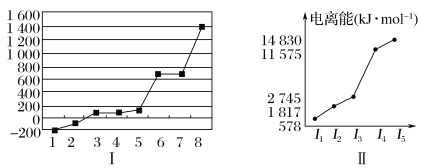
(5)第三周期8种元素按单质熔点高低的顺序如图Ⅰ所示,其中电负性最大的是________(填图中的序号)。
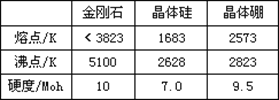
(6)表中所列的某主族元素的电离能情况如图Ⅱ所示,则该元素是________(填元素符号)。