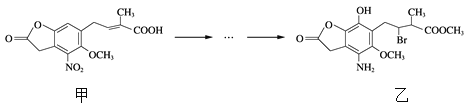
题目内容
【题目】铜及其化合物在工业生产及生活中用途非常广泛。回答下列问题:
(1)硫酸铜溶液呈蓝色,是因为其中含有[Cu(H2O)4]2+,该离子的结构简式为______(标出配位键,不考虑空间构型)。向硫酸铜溶液中滴加氨水会生成蓝色沉淀,再滴加氨水至沉淀刚全部溶解时可得到蓝色的[Cu(NH3)4SO4溶液,继续向其中加入乙醇会有蓝色晶体析出,原因是_______。
(2)新制Cu(OH)2悬浊液可将乙醛(CH3CHO)氧化成乙酸,而自身还原成Cu2O。乙酸的沸点高于乙醛的主要原因是____________。
(3)配合物[Cu(CH3CN)4]BF4[四氟硼酸四(乙腈)合铜(I)]是有机合成中常见催化剂。该配合物中与中心Cu形成配位健的原子_________。BF4-的空间构型为_____,与其互为等电子体的分子是_____________。
(4)已知:硫酸铜溶液中滴入氨基乙酸钠(H2NCH2COONa)即可得到配合物A。其结构如图所示。

①1mol氨基乙酸钠(H2NCH2COONa)含有σ键的数目为_______。
②标出配合物A中的配位键________。
【答案】  乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子间氢键,而乙醛不能 N 正四面体型 CCl4 8NA
乙醇降低了[Cu(NH3)4]SO4在水中的溶解度 乙酸能形成分子间氢键,而乙醛不能 N 正四面体型 CCl4 8NA 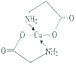 或
或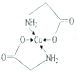
【解析】(1)考查配位键,Cu2+提供空轨道,H2O中O提供孤电子对,因此该离子的结构简式为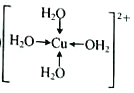 ;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氢键的形成条件,乙酸符合形成分子间氢键的条件,而乙醛不符合,因此乙酸能形成分子间氢键,而乙醛不能,因此乙酸的沸点比乙醛高;(3)考查配位键、空间构型、等电子体的判断,CH3CN中只有N有孤电子对,因此提供孤电子对的是N,即N与Cu形成配位键;BF4-中B含有4个σ键,孤电子对(3+1-4×1)/2=0,价层电子对数为4,空间构型为正四面体;与其互为等电子体的分子式为CCl4等;(4)考查化学键数目的判断。配位键的表示,①此化合物为离子化合物,是由H2NCH2COO-和Na+组成,1molH2NCH2COO-中含有σ键的数目是8NA;②Cu提供空轨道,O最外层6个电子,形成2个化学键,N最外层5个电子,形成三个共价键,达到稳定结构,根据化合物A的结构图,Cu和N形成配位键,即
;乙醇降低了[Cu(NH3)4]SO4在水中的溶解度;(2)考查氢键的形成条件,乙酸符合形成分子间氢键的条件,而乙醛不符合,因此乙酸能形成分子间氢键,而乙醛不能,因此乙酸的沸点比乙醛高;(3)考查配位键、空间构型、等电子体的判断,CH3CN中只有N有孤电子对,因此提供孤电子对的是N,即N与Cu形成配位键;BF4-中B含有4个σ键,孤电子对(3+1-4×1)/2=0,价层电子对数为4,空间构型为正四面体;与其互为等电子体的分子式为CCl4等;(4)考查化学键数目的判断。配位键的表示,①此化合物为离子化合物,是由H2NCH2COO-和Na+组成,1molH2NCH2COO-中含有σ键的数目是8NA;②Cu提供空轨道,O最外层6个电子,形成2个化学键,N最外层5个电子,形成三个共价键,达到稳定结构,根据化合物A的结构图,Cu和N形成配位键,即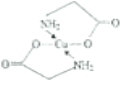 ,Cu配位数为4,因此还可以是
,Cu配位数为4,因此还可以是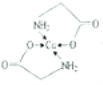 。
。