题目内容
【题目】FeCl2是一种重要的污水处理剂,具有易与水反应、易被氧化的性质。某兴趣小组在实验室中制备无水FeCl2并测定其纯度,设计了如下实验(夹持装置已略去,I中各装置不重复使用)。
Ⅰ.FeCl2的制备
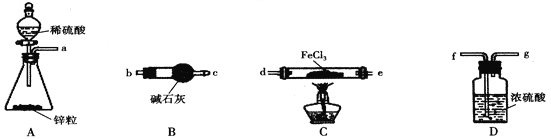
(1)加热条件下,H2与FeCl3制备无水FeCl2的化学方程式为______________________。
(2)按气流从左到右的方向,上图中装置合理的连接顺序为_________________(用仪器接口处的字母表示)。
(3)装置B的作用为____________。
(4)反应结束后,应先熄灭C处的酒精灯还是先关闭A处分液漏斗的活塞_______________(填“熄灭酒精灯”或“关闭活塞”)。
Ⅱ.FeCl2的纯度测定
已知:①实验得到固体的成分为FeCl2和FeCl3。
②Fe3+与K3[Fe(CN)6]不反应,3Fe2++2 [Fe(CN)6]3-![]() Fe3[Fe(CN)6]2↓。
Fe3[Fe(CN)6]2↓。
该兴趣小组设计了如下实验测定得到的FeCl2和FeCl3混合物中FeCl2的纯度。
(i)称取m g反应后的固体溶于过量盐酸中,再将所得溶液加水稀释到200 mL。
(ii)准确量取20 mL上述溶液于烧杯中,加入过量的K3[Fe(CN)6]溶液,有蓝色的Fe3[Fe(CN)6]2沉淀生成。
(iii)过滤、洗涤、干燥后进行称量,得到W g蓝色固体。
(5)产品中FeCl2的质量分数为____________________________(用含有m和ω的式子表示)。甲同学认为按照上述方案测得的FeCl2的质量分数偏低,他的理由为______________________
【答案】 2FeCl3+H2![]() 2FeCl2+3HCl afgde(ed)b(c) 吸收反应生成的氯化氢气体,防止其污染空气;防止空气中的水蒸气进入装置C与无水氯化亚铁反应 熄灭酒精灯 905w/296m×100% 在实验过程中会有部分FeCl2被空气中的氧气氧化为2FeCl3,使测得的w数值偏小,结果偏低
2FeCl2+3HCl afgde(ed)b(c) 吸收反应生成的氯化氢气体,防止其污染空气;防止空气中的水蒸气进入装置C与无水氯化亚铁反应 熄灭酒精灯 905w/296m×100% 在实验过程中会有部分FeCl2被空气中的氧气氧化为2FeCl3,使测得的w数值偏小,结果偏低
【解析】考查物质的制备和实验方案设计与评价,(1)H2与FeCl3反应制备FeCl2,Fe3+的化合价降低,H的化合价升高,转变为+1价,因此反应方程式为:2FeCl3+H2![]() 2FeCl2+3HCl;(2)首先是制气装置,即a开头,装置A中制备的氢气中含有水蒸气,连有干燥装置,根据制备FeCl2的反应方程式,有HCl的生成,HCl污染空气,应用碱石灰吸收,因此a连接f、g,g连接d、c或g连接c、d,d连接b,顺序是 afgde(ed)bc;(3)装置B的作用是吸收反应生成氯化氢气体,防止其污染空气,防止空气中的水蒸气进入装置C与无水氯化亚铁反应;(4)应先熄灭酒精灯,再通一段时间的氢气,让FeCl2冷却,防止被氧气氧化FeCl3;(5)根据反应方程式,求出Fe2+的物质的量为W×3/592mol,200mL的溶液中FeCl2的质量分数为W×3×127×200/(592×20)×100%=1905w/296m×100%,因为Fe2+容易被氧化,因此结果偏低的原因是:在实验过程中会有部分FeCl2被空气中的氧气氧化为FeCl3,使测得的w数值偏小,结果偏低。
2FeCl2+3HCl;(2)首先是制气装置,即a开头,装置A中制备的氢气中含有水蒸气,连有干燥装置,根据制备FeCl2的反应方程式,有HCl的生成,HCl污染空气,应用碱石灰吸收,因此a连接f、g,g连接d、c或g连接c、d,d连接b,顺序是 afgde(ed)bc;(3)装置B的作用是吸收反应生成氯化氢气体,防止其污染空气,防止空气中的水蒸气进入装置C与无水氯化亚铁反应;(4)应先熄灭酒精灯,再通一段时间的氢气,让FeCl2冷却,防止被氧气氧化FeCl3;(5)根据反应方程式,求出Fe2+的物质的量为W×3/592mol,200mL的溶液中FeCl2的质量分数为W×3×127×200/(592×20)×100%=1905w/296m×100%,因为Fe2+容易被氧化,因此结果偏低的原因是:在实验过程中会有部分FeCl2被空气中的氧气氧化为FeCl3,使测得的w数值偏小,结果偏低。





