题目内容
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
【答案】B
【解析】
试题分析:根据图像知ClO-的物质的量随反应的进行不断减小,则ClO-为反应物;N2的物质的量随反应的进行不断增大,则N2为生成物。结合题给信息利用化合价升降法结合原子守恒和电荷守恒配平,该反应的离子方程式为5ClO-+2CN-+H2O![]() 5Cl-+N2↑+2HCO3—。A、反应中,CN-中碳元素的化合价由+2价升高到+4价,转化为HCO3-,氮元素的化合价由-3价升高到0价,转化为N2,还原剂是含CN-的物质,氧化产物有N2和含HCO3—,正确;B、反应中,ClO-中氯元素的化合价由+1价降为-1价转化为Cl-,故氧化剂是ClO-,还原产物是Cl-,错误;C、根据反应方程式知参与反应的氧化剂与还原剂的物质的量之比为5:2,正确;D、根据反应方程式知标准状况下若生成2.24LN2则转移电子为1mol,正确。
5Cl-+N2↑+2HCO3—。A、反应中,CN-中碳元素的化合价由+2价升高到+4价,转化为HCO3-,氮元素的化合价由-3价升高到0价,转化为N2,还原剂是含CN-的物质,氧化产物有N2和含HCO3—,正确;B、反应中,ClO-中氯元素的化合价由+1价降为-1价转化为Cl-,故氧化剂是ClO-,还原产物是Cl-,错误;C、根据反应方程式知参与反应的氧化剂与还原剂的物质的量之比为5:2,正确;D、根据反应方程式知标准状况下若生成2.24LN2则转移电子为1mol,正确。

 阅读快车系列答案
阅读快车系列答案【题目】通常人们把拆开1 mol某化学键所消耗的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热。
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
E(kJ·mol1) | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),(已知1mol晶体Si中有2molSi-Si键),该反应的产生的热量为( )
Si(s)+4HCl(g),(已知1mol晶体Si中有2molSi-Si键),该反应的产生的热量为( )
A.吸收412 kJ·mol-1 B.放出412 kJ·mol-1
C.吸收236 kJ·mol-1 D.放出236 kJ·mol-1
【题目】(1)用正确的序号填空:
①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3 ;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
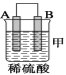
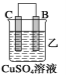
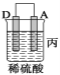
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 断溶解 | C的质 量增加 | A上有气 体产生 |
根据实验现象回答下列问题:
①装置甲中作正极的是_____ ___ (填“A”或“B”)。
②装置乙溶液中Cu2+向_____ __极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于___ ___(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是____ ___。