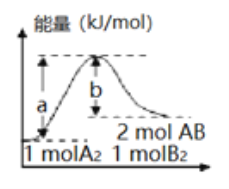
题目内容
【题目】新华网报道,我国固体氧化物燃料电池技术研发取得新突破。科学家利用该技术实现了H2S废气资源回收利用并获得能量,原理如图所示。下列说法正确的是( )
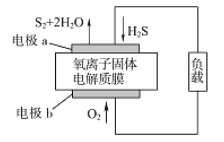
A. 电极b为电池负极
B. 电极a上的电极反应:2H2S+2O2--4e-=S2+2H2O
C. 电极b上的电极反应:O2+4e-+4H+=2H2O
D. 电路中每流过4mol电子,正极消耗44.8LH2S
【答案】B
【解析】根据2H2S+O2= S2+2H2O反应,得出H2S 在电极a上失电子发生氧化反应, 电极a做负极,电极反应为: 2H2S+2O2--4e-=S2+2H2O ,O2在电极b上得电子发生还原反应, 电极b做正极,电极反应为: O2+4e-=2O2- ,以此解答该题。
O2在电极b上得电子发生还原反应,则电极b为电池的正极,A错误;电极a上H2S失电子发生氧化反应,则电极反应为: 2H2S+2O2--4e-=S2+2H2O,B正确;电极b为O2得电子发生还原反应,电解质为含氧离子固体,电极反应为: O2+4e-=2O2- ,C错误;气体存在的条件未知,不能确定气体体积大小, D错误;正确选项B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目