题目内容
10. 某学习小组围绕氯气设计了系列实验.
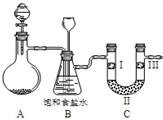
某学习小组围绕氯气设计了系列实验.(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
分析 (1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水;根据分液漏斗的使用方法解答;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl;C中若发生堵塞,则B中长颈漏斗下端导管中液面会上升;
(3)验证氯气是否具有漂白性,则先设计湿润的有色物质,再利用干燥剂干燥后与干燥的有色物质混合,注意Ⅱ中干燥剂为固态;
(4)将Cl2通入溴化亚铁溶液中,由于Fe2+的还原性比Br-的还原性强,所以发生反应有以下顺序:Cl2+2Fe2+═2Fe3++2Cl-;Cl2+2Br-═Br2+2Cl-;所以通入氯气的过程中先生成铁离子,后生成溴,溴溶于四氯化碳,颜色为红褐色.Fe3+的不溶于四氯化碳,但溶于水,水溶液是黄色;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,可能生成二氧化硫,污染环境.
解答 解:(1)漂粉精固体和浓盐酸,发生氧化还原反应生成氯化钙、氯气和水,该反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;
使用分液漏斗滴加液体的方法为:打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液,
故答案为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O;打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液;
(2)氯气中混有HCl,B中饱和食盐水可吸收HCl,则装置B的作用为除去氯气中的HCl;C中若发生堵塞,生成的氯气使B中压强增大,则B中长颈漏斗下端导管中液面会上升,形成水柱,
故答案为:除去氯气中的HCl;B中长颈漏斗下端导管中液面会上升,形成水柱;
(3)验证氯气是否具有漂白性,则先通过I中湿润的有色布条,观察到褪色,再利用II中固体干燥剂(无水氯化钙或硅胶)干燥后,在Ⅲ中放入干燥的有色布条,观察到颜色不褪,则验证氯气不具有漂白性,只有D符合,
故答案为:D;
(4)A.Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应,而且生成的Fe3+不再与溶液中的其他物质发生反应,因此从反应开始自始至终溶液中都有Fe3+,溶液始终为黄色,故A正确;
B.根据对A的分析可知水层为黄色,故B错误;
C.根据Fe2+、Br-的还原性的强弱为:Fe2+>Br-,当一种氧化剂遇到两种还原性不同的还原剂时先与还原性强的还原剂发生反应,因此通入氯气后先发生Cl2+2Fe2+═2Fe3++2Cl-;只有当Fe2+、反应完成后,再与Br-反应Cl2+2Br-═Br2+2Cl-;因此刚开始时四氯化碳层是无色的,当有溴生成时四氯化碳层才变为红棕色.故C错误;
D.根据对C的分析,当有溴产生时四氯化碳层就变为红棕色,故D错误;
故答案为:A;
(5)氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质,故工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,
故答案为:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质;
(6)F中可改用足量的NaHSO3溶液吸收余氯,发生氧化还原反应,反应的离子反应为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O),可能生成二氧化硫,污染环境,则不能用NaHSO3溶液吸收尾气,
故答案为:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O);否.
点评 本题考查了物质制备、性质实验方案的设计,题目难度中等,明确实验目的及实验原理为解答关键,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及化学实验能力,注意熟练掌握物质性质、制备方案的设计原则.

| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
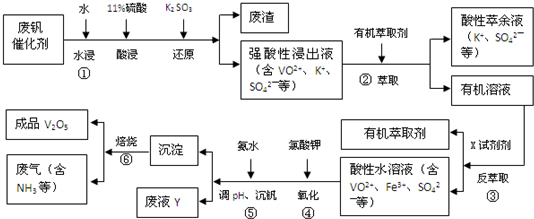
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4)n(水层)+2n HA(有机层)?2RAn(有机层)+n H2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
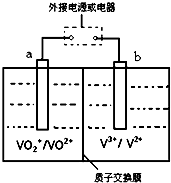
①全矾液流电池的工作原理为:VO2++V2++2H+ $?_{()电}^{()电}$VO2++H2O+V3+(请在可逆符号两侧的括号中填“充”、“放”)此时,b极接直流电源负极.
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O,当转移1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”).
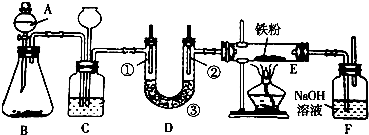
(1)欲利用浓盐酸与B不加热制取氯气,则B可选用下列物质中的bc;
a.MnO2 b.Ca(ClO)2 c.KMnO4 d.NaCl
(2)C装置的作用是安全瓶;C中加入饱和食盐水 溶液;当C后面的装置发生堵塞时,C中的现象是:长颈漏斗中液面上升.
(3)装置D用于验证氯气的漂白性,①是湿润的有色布条 ③是无水氯化钙或五氧化二磷
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
| 实验方法 | 实验现象 | 实验结论 |
| 1.取反应初始阶段(氯气不足量)E中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液,①加入KSCN溶液,②加入KMnO4溶液 | ① ② | 生成物中没有FeCl2 生成物中含有FeCl3 |
| 2.取充分反应后(氯气通入足够长时间)E中产物,溶于水中,加入KMnO4溶液 | KSCN溶液显红色, KMnO4溶液不褪色 |
| A. | Ba(OH)2+H2SO4═BaSO4↓+2H2O既是放热反应又是氧化还原反应 | |
| B. | CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O反应物的总能量低于生成物的总能量 | |
| C. | C(石墨)$\frac{一定条件}{\;}$C(金刚石)是吸热反应,所以金刚石比石墨更稳定 | |
| D. | 吸热反应和放热反应都遵守能量守恒定律 |
| A. | 使用催化剂能改变反应速率 | B. | 升高温度能加快反应速率 | ||
| C. | 降低压强能减小反应速率 | D. | 改变压强对反应速率没有影响 |

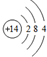 ;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).
;写出其单质的一种重要用途用作半导体材料(或用作太阳能电池板或制作计算机芯片).