题目内容
【题目】工业上可利用CO或CO2来生产燃料甲醇。
I.已知甲醇制备的有关化学反应以及在不同温度下的化学反应平衡常数如下所示:
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g) | K3 | |||
请回答下列问题:
(1)反应②是________(填“吸热”或“放热”)反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,则K3=__________(用K1、K2表示)。
II.CO使其在一定条件下和H2反应制备甲醇,请根据图示回答下列问题:
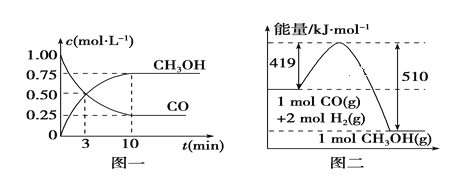
(1)写出制备甲醇的热化学方程式:__________________________________________
(2)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=______________。
(3)某温度下,在一体积不变的密闭容器中充入2.5molCO、7.5molH2,达到平衡吋测得CO的转化率为90%,此时容器内的压强是起始的___________倍。
【答案】吸热 K1K2 2H2(g)+CO(g) ![]() CH3OH(g) ΔH = - 91 kJ/mol 0.15 molL-1min-1 0.6
CH3OH(g) ΔH = - 91 kJ/mol 0.15 molL-1min-1 0.6
【解析】
I.(1)反应②升温,K增大,说明升温向吸热反应即正向是吸热反应。
(2)据反应①与②可推导出K1、K2与K3之间的关系,方程式相加,K相乘,因此K3=K1K2。
II.(1)根据图二的能量图得出甲醇的热化学方程式:2H2(g)+CO(g) ![]() CH3OH(g) ΔH = 419kJ/mol - 510 kJ/mol = - 91 kJ/mol。
CH3OH(g) ΔH = 419kJ/mol - 510 kJ/mol = - 91 kJ/mol。
(2)从反应开始到平衡,用CO浓度变化表示平均反应速率![]() ,用H2浓度变化表示平均反应速率v(H2)=2 v(CO)。
,用H2浓度变化表示平均反应速率v(H2)=2 v(CO)。
(3)
2H2(g) + CO(g) ![]() CH3OH(g)
CH3OH(g)
开始:7.5mol 2.5mol 0
转化:4.5mol 2.25mol 2.25mol
平衡:3mol 0.25mol 2.25mol
![]() 。
。
I.(1)反应②升温,K增大,说明升温向吸热反应即正向是吸热反应,故答案为:吸热。
(2)据反应①与②可推导出K1、K2与K3之间的关系,方程式相加,K相乘,因此K3=K1K2,故答案为:K1K2。
II.(1)根据图二的能量图得出甲醇的热化学方程式:2H2(g)+CO(g) ![]() CH3OH(g) ΔH = 419kJ/mol - 510 kJ/mol = - 91 kJ/mol,故答案为:2H2(g)+CO(g)
CH3OH(g) ΔH = 419kJ/mol - 510 kJ/mol = - 91 kJ/mol,故答案为:2H2(g)+CO(g) ![]() CH3OH(g) ΔH = - 91 kJ/mol,
CH3OH(g) ΔH = - 91 kJ/mol,
(2)从反应开始到平衡,用CO浓度变化表示平均反应速率![]() ,用H2浓度变化表示平均反应速率v(H2)=2 v(CO) = 2×0.075molL-1min-1 = 0.15 molL-1min-1,故答案为:0.15 molL-1min-1。
,用H2浓度变化表示平均反应速率v(H2)=2 v(CO) = 2×0.075molL-1min-1 = 0.15 molL-1min-1,故答案为:0.15 molL-1min-1。
(3)
2H2(g) + CO(g) ![]() CH3OH(g)
CH3OH(g)
开始:7.5mol 2.5mol 0
转化:4.5mol 2.25mol 2.25mol
平衡:3mol 0.25mol 2.25mol
![]() ,故答案为:0.6。
,故答案为:0.6。