题目内容
【题目】现有14.4 g CO和CO2的混合气体,在标准状况下所占的体积约为8.96 L。回答下列问题:
(1)混合气体中碳原子的个数________。(用NA表示阿伏加德罗常数的值)
(2)该混合气体的平均摩尔质量________g/mol。
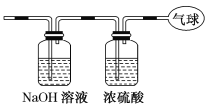
(3)将混合气体依次通过如图装置,最后收集在气球中。气球中收集到的气体是________,标准状况下气球中收集到的气体的体积为________L,如果上述装置中使用的浓硫酸失效,则气球中气体的相对分子质量会________(填“变大”、“变小”或“不受影响”)。
【答案】0.4NA 36 CO 4.48 L变小
【解析】
(1)设混合气体中CO的物质的量为xmol,CO2的物质的量为ymol,则根据混合物的质量为14.4g可得:28x+44y=14.4 ①;
根据气体的物质的量为![]() =0.4mol可得:x+y=0.4 ②
=0.4mol可得:x+y=0.4 ②
解①②得:x=0.2mol、y=0.2mol;一氧化碳、二氧化碳物质的量都是0.2mol,由于CO和CO2中均含1个碳原子,故0.2molCO和0.2molCO2中共含0.4molC原子即0.4NA个;
(2)将混合气体依次通过如图装置,则CO2会被NaOH溶液吸收,剩余CO,被浓硫酸干燥后,则在气球中收集到的是干燥纯净的CO气体。气球中收集到的气体为CO,而一种物质的摩尔质量在数值上等于该物质的相对分子质量,故收集到气体的摩尔质量为28g/mol;
(3)气球中的气体为CO,其体积V=nVm=0.2mol×22.4L/mol=4.48L;如果上述装置中使用的浓硫酸失效,则水蒸气进入气球中,水的摩尔质量小于一氧化碳,则气球中气体的相对分子质量会变小。

练习册系列答案
 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目