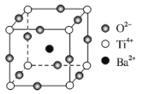
题目内容
【题目】1909年化学家哈伯在实验室首次合成了氨。2007年化学家格哈德·埃特尔在哈伯研究所证实了氢气与氮气在固体表面合成氨的反应过程,示意如下图:
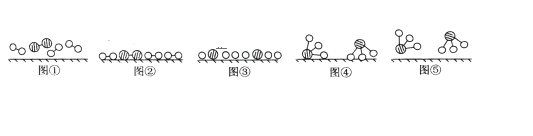
(1)图⑤表示生成的NH3离开催化剂表面,图③的含义分别是_____________。
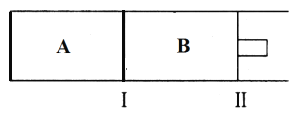
(2)500℃下,在A、B两个容器中均发生合成氨的反应。起始两容器充入两气体两相同,体积相同,隔板Ⅰ固定不动,活塞Ⅱ可自由移动。
①两容器的N2的转化率关系为αA____αB(填“>”、“<”或“=”)
②在B容器中,反应达到平衡的标志有________。
A 容器中气体压强不再发生变化
B 容器中气体密度不再发生变化
C 容器中气体平均摩尔质量不再发生变化
③当合成氨在容器B中达平衡时,测得其中含有1.0molN2,0.4molH2,0.4molNH3,此时容积为2.0L。保持温度和压强不变,向此容器中通入0.36molN2,平衡将____________(填“正向”、“逆向”或“不”)移动。
④向A、B两容器中均通入xmolN2和ymolH2,初始A、B容积相同,并保持温度不变。若要平衡时保持N2在A、B两容器中的体积分数相同,则x与y之间必须满足的关系式为__________。
【答案】氮气,氢气在催化剂表面断键 < BC 逆向 X=Y
【解析】
(1)从图中直接观察,图②中分子内原子间存在短线,图③中原子间的短线消失,显然是断键。
(2) ①A容积固定,B压强固定,所以B相当于A加压。
②判断平衡状态时,因为提供的量都是体系的总量,所以只要分析此总量是否为变量,若为变量,变量不变即为平衡状态。
③利用三段式求出平衡时各量,然后求出平衡常数,再利用浓度商与平衡常数的数值关系,确定平衡移动的方向。
④利用三段式建立等量关系,求解。
(1)比较各图中分子的变化、分子间化学键的变化,图⑤表示生成的NH3离开催化剂表面,图③的含义分别是氮气、氢气在催化剂表面断键;
答案:氮气、氢气在催化剂表面断键。
(2)①随着反应的不断进行,容器A内气体的压强不断减小,容器B相当于容器A加压,平衡正向移动,N2的转化率增大,所以两容器的N2的转化率关系为αA< αB;
答案:<;
②A. 随着反应的进行,容器中气体压强始终不变,所以压强不变不一定达平衡状态;
B. 随着反应的进行,体积改变、质量不变,所以若容器中气体密度不再发生变化,则达平衡状态;
C. 随着反应的进行,气体的质量不变,但物质的量改变,所以若容器中气体平均摩尔质量不再发生变化,则反应达平衡状态。
答案:BC。
③K=![]() 。
。
压强一定时,1.8mol气体,体积为2.0L;向容器内通入0.36molN2,则气体共2.16mol,体积应为2.4L。
Q= >10,所以平衡逆向移动;
>10,所以平衡逆向移动;
答案:逆向。
④设A、B容器中,N2的变化量分别 为a、b
N2 + 3H2 ![]() 2NH3
2NH3
起始量 x y 0
变化量 a 3a 2a
平衡量 a-a y-3a 2a
N2 + 3H2 ![]() 2NH3
2NH3
起始量 x y 0
变化量 b 3b 2b
平衡量 x-b y-3b 2b
依题意得:![]() ,
,
解之得:![]()
所以:x=y;
答案:x=y。

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案