题目内容
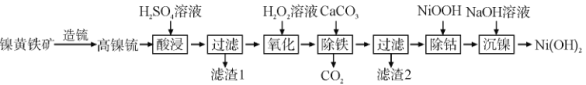
【题目】以镍黄铁矿为原料制备![]() 的工艺流程如下:
的工艺流程如下:
已知:①高镍锍的主要成分为![]() 、
、![]() 、
、![]() 、
、![]() 的低价硫化物及合金;
的低价硫化物及合金;
②氧化性:![]() ;
;
③![]() ,
,![]() ,
,![]() 。
。
回答下列问题:
(1)“酸浸”时,![]() 溶液需过量,其目的是________。
溶液需过量,其目的是________。
(2)“氧化”时反应的化学方程式为________,若用![]() 代替
代替![]() 溶液,使
溶液,使![]() 转化为
转化为![]() ,则需
,则需![]() 至少为________
至少为________![]() 。
。
(3)“除铁”的原理是________。
(4)“过滤”时滤渣1的主要成分是________。
(5)“沉镍”后需过滤、洗涤,证明沉淀已洗涤干净的方法是________________。若“沉镍”后的滤液中![]() ,则滤液的
,则滤液的![]() ________。
________。
(6)“除钴”时,发生反应的离子方程式为________。
【答案】提高镍元素的浸取率 ![]() 0.1
0.1 ![]() 与
与![]() 反应使溶液
反应使溶液![]() 升高,
升高,![]() 解生成
解生成![]() 沉淀而除去
沉淀而除去 ![]() 、
、![]() 取最后一次洗涤液少量,向其中滴加盐酸酸化的
取最后一次洗涤液少量,向其中滴加盐酸酸化的![]() 溶液,若无白色沉淀生成,则沉淀已洗涤干净 9
溶液,若无白色沉淀生成,则沉淀已洗涤干净 9 ![]()
【解析】
用硫酸溶液溶解高镍铳并过滤,除去不溶于酸和水的杂质Cu和CuS,同时得到含有Ni2+、Fe2+及Co2+的滤液,向滤液加入H2O2主要是氧化溶液中的Fe2+得Fe3+,后用CaCO3调节溶液pH,使Fe3+转化为Fe(OH)3沉淀,通过过滤除去,达到除铁的目的,过滤后的滤液中继续加入NiOOH,可生成Co(OH)3,再过滤除去,达到除钴的目的,最后滤液中加入NaOH溶液,并过滤即可得到Ni(OH)2。
(1)“酸浸”时,加入过滤的硫酸溶液,可使高镍铳完全溶解,提高镍元素的浸取率;
(2) H2O2氧化溶液中的Fe2+得Fe3+,发生反应的化学方程式为2FeSO4+H2O2+H2SO4=Fe2(SO4)3+2H2O;若用NaClO代替H2O2溶液,使0.2mol Fe2+转化为Fe3+,共转移0.2mole-,NaClO的还原产物为NaCl,则需NaClO至少为![]() =0.1mol;
=0.1mol;
(3)Fe3+在溶液中存在水解平衡为Fe3++3H2O![]() Fe(OH)3+3H+,加入CaCO3能与H+反应使溶液pH升高,Fe3+水解生成Fe(OH)3沉淀而除去;
Fe(OH)3+3H+,加入CaCO3能与H+反应使溶液pH升高,Fe3+水解生成Fe(OH)3沉淀而除去;
(4)由分析知,“过滤”时滤渣1的主要成分是不溶液于稀硫酸的Cu为CuS;
(5) Ni(OH)2的表面附着液中含有SO42-,则取最后一次洗涤液少量,向其中滴加盐酸酸化的BaCl2溶液,若无白色沉淀生成,则沉淀已洗涤干净;已知Ksp[Ni(OH)2]=1×10-15=c(Ni2+)×c2(OH-),则c(OH-)=![]() mol/L=10-5mol/L,此时溶液pH=9;
mol/L=10-5mol/L,此时溶液pH=9;
(6)“除钴”时NiOOH可生成Co(OH)3,则发生反应的离子方程式为NiOOH+Co2++H2O=Ni2++Co(OH)3。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案【题目】在药物制剂中,抗氧剂与被保护的药物在与![]() 发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。
发生反应时具有竞争性,抗氧性强弱主要取决于其氧化反应的速率。![]() 、
、![]() 和
和![]() 是三种常用的抗氧剂。已知:
是三种常用的抗氧剂。已知:![]() 溶于水发生反应:
溶于水发生反应:![]() ;
;![]() 以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
以原溶液和一定量的酸或碱混合,保持总体积不变的方式调节pH。
实验用品 | 实验操作和现象 |
| 实验1:溶液 |
| 实验2:溶液
|
| 实验3:调溶液 |
下列说法中不正确的是 ![]()
A.![]() 溶液显碱性,原因是
溶液显碱性,原因是![]()
B.![]() 溶液中
溶液中![]() 的电离程度大于水解程度
的电离程度大于水解程度
C.实验2说明,![]() 在
在![]() 时抗氧性最强
时抗氧性最强
D.实验3中,三种溶液在pH相同时起抗氧作用的微粒种类和浓度相同,因此反应速率相同