题目内容
【题目】过量的SO2通入下列溶液中,不可能产生沉淀的是( )
A. 氯化钡和氯化铁的混合液 B. 氢氧化钙溶液
C. 硫化氢溶液 D. 硅酸钠溶液
【答案】B
【解析】氯化铁把二氧化硫气体氧化为硫酸根离子,硫酸根离子与钡离子反应生成硫酸钡沉淀,A错误;氢氧化钙溶液与过量的SO2反应生成亚硫酸氢钡溶液,没有沉淀生成,B正确;C. 硫化氢溶液与SO2反应生成单质硫黄色固体,C错误;D. SO2与水反应生成亚硫酸,亚硫酸的酸性强于硅酸,而硅酸是白色沉淀,D错误;答案选B。

 期末冲刺100分创新金卷完全试卷系列答案
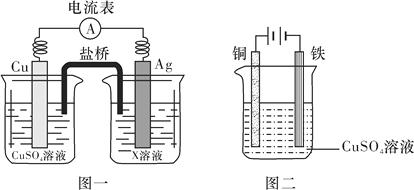
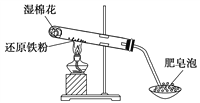
期末冲刺100分创新金卷完全试卷系列答案【题目】某校甲、乙两个化学小组学生利用下图所示装置进行“铁与水反应及相关性质”的实验。

(1)装置B中发生反应的化学方程式是____________________________________。
(2)装置E中的现象是___________________________________________________。
(3)将探究小组分为两组,按题图装置进行对比实验,甲组用洒精喷灯、乙组用洒精灯加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,无气泡 |
2 | 取少骤1中溶液,滴加酸性KMnO4溶液 | 紫色褪去 | 紫色褪去 |
3 | 取步骤1中溶液,滴加KSCN溶液 | 变红 | 无现象 |
4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变红,后褪色 |
①乙组得到的黑色粉末是________________________。
②甲组步骤1中反应的离子方程式为______________________________________。
③乙组步骤4中,溶液变红的原因为____________________、___________________;(用离子方程式表示);溶液褪色可能的原因是_____________________________;验证方法为________________________________________。