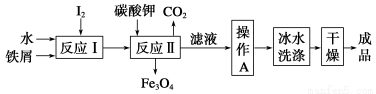
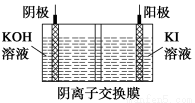
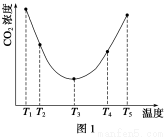
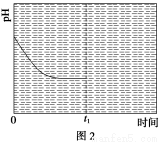
题目内容
(Ⅰ)在室温下,向某一容积固定的真空容器内充入丁烷(气)和氧气,使容器内混合气的总压强达到p1,点火燃烧,氧气反应完全,冷却至室温后容器内气体的总压强为p2。
(1)若丁烷燃烧的生成物只有H2O(液)和CO2,则p2/p1= 。
(2)若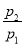 =0.64,则反应前混合气中丁烷的物质的量分数= 。
=0.64,则反应前混合气中丁烷的物质的量分数= 。
(Ⅱ)设阿伏加德罗常数为NA,在常温常压下气体的摩尔体积为Vm L·mol-1,O2和N2的混合气体a g含有b个分子,则c g该混合气体在常温常压下所占的体积应是 L。
(Ⅰ)(1)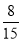 (2)16% (Ⅱ)
(2)16% (Ⅱ)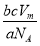
【解析】(Ⅰ)2C4H10+13O2点燃,8CO2+10H2O
(1)由于室温下水为液体,所以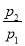 =
=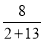 =
=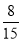 。
。
(2)由于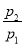 =0.64>
=0.64>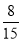 ,所以丁烷过量,产物为CO、CO2和H2O(l),根据碳元素守恒,CO和CO2的物质的量之和等于4倍的C4H10的物质的量,设C4H10、O2的物质的量分别为a、b,则
,所以丁烷过量,产物为CO、CO2和H2O(l),根据碳元素守恒,CO和CO2的物质的量之和等于4倍的C4H10的物质的量,设C4H10、O2的物质的量分别为a、b,则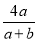 =0.64,
=0.64,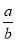 =
=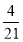 ,所以丁烷的物质的量分数为
,所以丁烷的物质的量分数为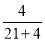 ×100%=16%。
×100%=16%。
(Ⅱ)设该混合气体的摩尔质量为M,则:
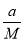 ·NA=b,则M=
·NA=b,则M=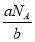 (g·mol-1),所以c g该气体在常温常压下所占的体积应是
(g·mol-1),所以c g该气体在常温常压下所占的体积应是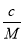 ·Vm=
·Vm=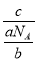 ·Vm=
·Vm=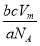 。
。

练习册系列答案
相关题目