题目内容
15.下列说法正确的是( )| A. | 需要0.2molNaOH固体,在托盘天平上称量时,砝码加上游码的质量等于0.8g | |
| B. | 配制一定物质的量浓度的NaCl溶液,定容时仰视凹液体,会导致溶液的浓度偏低 | |
| C. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| D. | AgCl难溶于水,在水中导电性较差,所以AgCl是非电解质 |
分析 A.需要0.2molNaOH固体,则需要0.2mol×40g/mol=8g;
B.定容时仰视刻度线,溶液的体积偏大;
C.同素异形体的转化中没有化合价的变化;
D.AgCl溶于水的部分完全电离,AgCl为强电解质.
解答 解:A.需要0.2molNaOH固体,则需要0.2mol×40g/mol=8g,所以砝码加上游码的质量等于8g,故A错误;
B.配制一定物质的量浓度的溶液,定容时仰视刻度线,溶液的体积偏大,由c=nVnV可得,所配溶液浓度偏低,故B正确;
C.同素异形体的转化中没有化合价的变化,如O2═O3,则有单质参加或单质生成的化学反应不一定是氧化还原反应,故C错误;
D.电解质强弱与溶液导电性没有必然关系,AgCl溶于水的部分完全电离,所以AgCl为强电解质,故D错误;
故选:B.
点评 本题主要考查了溶液的配置、氧化还原反应的判断、电解质的分析判断,难度不大,掌握基础是解题的关键.

练习册系列答案
相关题目
5.下列各组中的性质比较,正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO>H2SO3>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br->I- |
6.在下列反应中,水既不是氧化剂又不是还原剂的是( )
| A. | 2 Na+2 H2O═2 NaOH+H2↑ | B. | 3 NO2+H2O═2 HNO3+NO | ||
| C. | 2 F2+2 H2O═4 HF+O2↑ | D. | 2 H2O电解_电解–––––2 H2↑+O2↑ |
3.下列有关胶体的说法不正确的是( )
| A. | 电泳现象可证明胶体带有电荷 | |
| B. | 分散质粒子直径介于10-9 m~10-7m之间的分散系称为胶体 | |
| C. | 向Fe(OH)3胶体中滴入少量稀H2SO4,有红褐色沉淀产生 | |
| D. | 放电影时,放映室射到银幕上的光柱的形成属于丁达尔效应 |
10.将钠、镁、铝各0.3mol分别投入200ml 1mol/L的盐酸中,同温同压下产生的气体体积之比是( )
| A. | 1:2:3 | B. | 3:2:2 | C. | 3:1:1 | D. | 1:1:1 |
4.下列4种有机化合物中,能够发生酯化、加成和氧化3种反应是( )
| A. | CH2=CHCOOH | B. | CH2=CHCOOCH3 | C. | CH2=CHCH2OH | D. | CH3CH2CH2OH |

 .
. ,其名称为2,3-二甲基-2-丁烯.
,其名称为2,3-二甲基-2-丁烯. .
.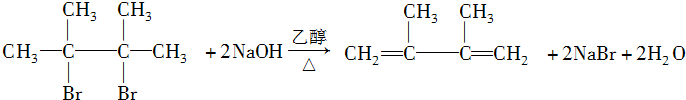 ;写出由E→F2的化学方程式:
;写出由E→F2的化学方程式: .
.