题目内容
【题目】(1)肼(N2H4)是火箭推进器中常用的高能燃料,已知0.4mol液态肼和足量H2O2反应,生成N2和水蒸气,放出256.65kJ的热量,请写出该反应的热化学方程式:__________________________。
(2)工业上制氢气的一个重要反应是:CO(g)+H2O(g)=CO2(g)+H2(g)
已知在25℃时:C(石墨)+ ![]() O2(g)=CO(g)△H1=-111kJ·mol-1
O2(g)=CO(g)△H1=-111kJ·mol-1
H2(g)+ ![]() O2(g)=H2O(g)△H2=-242kJ·mol-1
O2(g)=H2O(g)△H2=-242kJ·mol-1
C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1
试计算25℃时一氧化碳与水作用转化为氢气和二氧化碳反应的反应热△H=________kJ·mol-1
(3)高铁酸钾(K2FeO4)可作净水剂,也可用于制造高铁电池。高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,该电池放电时正极反应式为____________。
(4)用该电池电解100mL1mol·L-1的AgNO3溶液,写出电解反应方程式:____________________。当电路中通过0.01mol电子时,被电解溶液的pH为________(溶液体积变化忽略不计)。
【答案】 N2H4(l)+2H2O(l)=N2(g)+4H2O△H=-641.625kJ/mol -41 FeO42-+4H2O+3e-=Fe(OH)3+5OH- 4AgNO3+2H2O=4Ag+O2+4HNO3 1
【解析】(1)0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量,1mol液态肼与足量液态双氧水反应时放出的热量641.625kJ,则热化学方程式为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJmol-1,故答案为:N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.625 kJmol-1;
(2)①C(石墨)+ ![]() O2(g)=CO(g)△H1=-111kJ·mol-1,②H2(g)+
O2(g)=CO(g)△H1=-111kJ·mol-1,②H2(g)+ ![]() O2(g)=H2O(g)△H2=-242kJ·mol-1,③C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1,依据盖斯定律③-②-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:-41;
O2(g)=H2O(g)△H2=-242kJ·mol-1,③C(石墨)+O2(g)=CO2(g)△H3=-394kJ·mol-1,依据盖斯定律③-②-①得到:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;故答案为:-41;
(3)根据总反应3Zn+2K2FeO4+8H2O=3Zn(OH)2+Fe(OH)3+4KOH,高铁酸钾在正极得到电子,发生还原反应,电极反应式为FeO42-+4H2O+3e-=Fe(OH)3+5OH-,故答案为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-;
(4)该电池电解100mL 1molL-1的AgNO3溶液,阳极: 2H2O—4e- = O2↑+ 4H+,阴极:4Ag+ + 4e- = 4Ag↓,总方程式:4AgNO3 + 2H2O ![]() 4Ag↓+ O2↑+ 4HNO3。根据阳极的电极反应:2H2O—4e- = O2↑+ 4H+,所以产生的H+的物质的量为0.01mol,其物质的量浓度为
4Ag↓+ O2↑+ 4HNO3。根据阳极的电极反应:2H2O—4e- = O2↑+ 4H+,所以产生的H+的物质的量为0.01mol,其物质的量浓度为![]() =0.1mol/L,所以pH=1,故答案为:4AgNO3+2H2O=4Ag+O2+4HNO3;1。
=0.1mol/L,所以pH=1,故答案为:4AgNO3+2H2O=4Ag+O2+4HNO3;1。

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
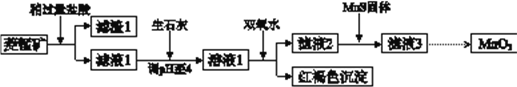
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。