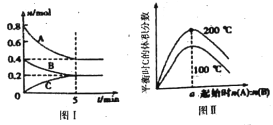
题目内容
【题目】向10 mL浓度均为3 mol·L-1的HNO3与H2SO4的混合溶液中加入1.92 g铜,充分反应后,设溶液体积仍为10 mL。求:
(1)产生的气体在标准状况下的体积是多少升_____?
(2)反应后溶液中各溶质的离子浓度是多少 ______? (反应完溶液中溶质的离子有Cu2+、H+、、NO3-、 SO42-)(以上要求写出计算过程)
【答案】0.448 L Cu2+:3 mol·L-1 H+:1 mol·L-1 NO3-:1 mol·L-1 SO42-:3 mol·L-1
【解析】
根据铜与稀硝酸反应的离子反应过程分析解答。
(1)n(Cu)= ![]() =0.03mol,n(H+)=3molL-1×0.01L×1+3molL-1×0.01L×2=0.09mol,n(NO3-)=3molL-1×0.01L=0.03mol,根据离子反应方程式:3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O 可知,Cu完全反应,H+和NO3-过量,由反应的离子方程式可知:n(NO)=0.03mol×2÷3=0.02mol, V(NO)=0.02mol×22.4L/mol=0.448L;
=0.03mol,n(H+)=3molL-1×0.01L×1+3molL-1×0.01L×2=0.09mol,n(NO3-)=3molL-1×0.01L=0.03mol,根据离子反应方程式:3Cu+8H++2NO3-=3 Cu2++2NO↑+4H2O 可知,Cu完全反应,H+和NO3-过量,由反应的离子方程式可知:n(NO)=0.03mol×2÷3=0.02mol, V(NO)=0.02mol×22.4L/mol=0.448L;
故答案为:0.448 L;
(2) 由离子方程式可知1.92 g Cu为0.03 mol,反应中消耗H+ 0.08 mol,消耗NO3- 0.02 mol,生成Cu2+ 0.03 mol,可得:c(Cu2+)=0.03mol÷0.01L=3 mol·L-1,反应后c(H+)=(0.09mol-0.08mol) ÷0.01L=1 mol·L-1,反应后n(NO3-)=0.03-0.02=0.01mol,故c(NO3-)=0.01mol÷0.01L=1 mol·L-1,因为SO42-没有参加反应,故SO42-的离子浓度仍为3 mol·L-1。
故答案为:Cu2+:3 mol·L-1,H+:1 mol·L-1,NO3-:1 mol·L-1,SO42-:3 mol·L-1。

 小题狂做系列答案
小题狂做系列答案【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
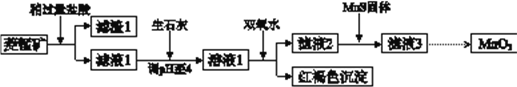
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________。盐酸溶解MnCO3的化学方程式是_________。
(2)向溶液1中加入双氧水时,反应的离子方程式是___________。
(3)滤液2中加入稍过量的难溶电解质MnS,以除去Cu2+,反应的离子方程式是__________。
(4)将MnCl2转化为MnO2的一种方法是氧化法。用酸化的NaClO3溶液将MnCl2氧化生成MnO2和Cl2,该反应的离子方程式为___________。
(5)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是___________。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_________。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是_________。