��Ŀ����
����Ŀ����֪��25��ʱ�����ᡢ̼���������ĵ���ƽ�ⳣ�����±���
���� | ̼�� | ������ |
Ka=1.75��10��5 | Ka1=4.30��10��7 Ka2=5.61��10��11 | Ka1=1.54��10��2 Ka2=1.02��10��7 |
��1��д��̼��ĵ�һ������ƽ�ⳣ������ʽ��Ka1=__��
��2������ͬ�����£��ԱȽ�H2CO3��HCO3����HSO3��������ǿ����__��__��__��
��3����ͼ��ʾ����ʱϡ�ʹ��ᡢ̼���������ϡ��Һʱ����ҺpH��ˮ���ı仯ͼ���У�
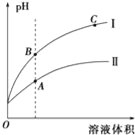
������I��ʾ������__���ѧʽ����
��A��B��C�����У�ˮ�ĵ���̶�������__������ĸ����
��4��������ʵ����˵���������������_______
�ٵ��¶ȵ���16.6��ʱ���������ɱ�һ������
��0.1mol/L�Ĵ�������Һ��pHԼΪ9
�۵���������ʵ���Ũ�ȵ�����ȴ��������������ƶ�
��0.1mol/L�Ĵ����pHԼΪ4.8
��pH������4�ҵ�����Ĵ�������ᣬ���Ũ��NaOH��Һ��ַ�Ӧʱ���������ļ�Һ��
��ͬ���ʵ���Ũ�ȵĴ���������ˮϡ����pH��ͬʱ����������ˮ��
���𰸡� c��H+��c��HCO3-��/c��H2CO3�� H2CO3 HSO3- HCO3- CH3COOH C �٢�
��������������Ҫ��������ĵ���ƽ�⡣
��1��̼��ĵ�һ������ƽ�ⳣ������ʽ��Ka1= c��H+��c��HCO3-��/c��H2CO3����
��2������ͬ�����£�̼���Ka1>�������Ka2>̼���Ka2������H2CO3>HSO3->HCO3-��
��3��������I��pH����Һ����仯��������������I��ʾ����������CH3COOH��
��A��B��C�����У�ˮ�ĵ���̶����������������ļ�pH����C��
��4���ٴ�����۵�������Ƿ�����û�й�ϵ���ʢٲ���˵������������ڴ�������Һ�ʼ��ԣ�˵��������ˮ�⣬���������ᣬ�ʢ���˵�������������˵�������Ԫ�����ڴ��ᣬ������Ƿ�����û�й�ϵ���ʢ۲���˵���������������������ǿ�ᣬ��0.1mol/L�����pH=1���ʢ���˵�������������˵���������̶ȱ��Ȼ���С���ʢ���˵����������������pH����Һ����仯�������ʢ�˵�����������ᣬ��ѡ�٢���

����Ŀ��һ���¶��£������������Ϊ1.0 L�ĺ����ܱ������У���Ӧ2H2(g)+CO(g) ![]() CH3OH(g)�ﵽƽ�⡣����˵������ȷ����
CH3OH(g)�ﵽƽ�⡣����˵������ȷ����
���� | �¶�/K | ��ʼŨ��/(mol/L) | ƽ��Ũ��/(mol/L) | ||
H2 | CO | CH3OH | CH3OH | ||
�� | 400 | 0.20 | 0.10 | 0 | 0.08 |
�� | 400 | 0.40 | 0.20 | 0 | X |
�� | 500 | 0 | 0 | 0.10 | 0.025 |
A. X = 0.16 B. �÷�Ӧ������Ӧ�Ƿ��ȷ�Ӧ
C. ƽ��ʱ�ķ�Ӧ����:��>�� D. 400 K ʱ�÷�Ӧƽ�ⳣ����ֵΪ2500