题目内容
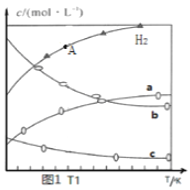
【题目】一定温度下,在三个体积均为1.0 L的恒容密闭容器中,反应2H2(g)+CO(g) ![]() CH3OH(g)达到平衡。下列说法不正确的是
CH3OH(g)达到平衡。下列说法不正确的是
容器 | 温度/K | 起始浓度/(mol/L) | 平衡浓度/(mol/L) | ||
H2 | CO | CH3OH | CH3OH | ||
① | 400 | 0.20 | 0.10 | 0 | 0.08 |
② | 400 | 0.40 | 0.20 | 0 | X |
③ | 500 | 0 | 0 | 0.10 | 0.025 |
A. X = 0.16 B. 该反应的正反应是放热反应
C. 平衡时的反应速率:②>① D. 400 K 时该反应平衡常数的值为2500
【答案】A
【解析】A. 400K时,2H2(g)+CO(g) ![]() CH3OH(g),氢气和一氧化碳的起始浓度为1:2,相当于增大压强,平衡正向移动,则平衡浓度小于1:2,因此X大于0.08×2=0.16,故A错误;B. 根据表格数据,①和③的起始浓度等效,升高温度,CH3OH的平衡浓度减小,平衡逆向移动,说明该反应的正反应是放热反应,故B正确;C. 压强越大,反应速率越快,平衡时的反应速率:②>①,故C正确;D. 根据表格数据①,400K时该反应平衡常数K=
CH3OH(g),氢气和一氧化碳的起始浓度为1:2,相当于增大压强,平衡正向移动,则平衡浓度小于1:2,因此X大于0.08×2=0.16,故A错误;B. 根据表格数据,①和③的起始浓度等效,升高温度,CH3OH的平衡浓度减小,平衡逆向移动,说明该反应的正反应是放热反应,故B正确;C. 压强越大,反应速率越快,平衡时的反应速率:②>①,故C正确;D. 根据表格数据①,400K时该反应平衡常数K=![]() =2500,故D正确;故选A。
=2500,故D正确;故选A。

【题目】已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表:
醋酸 | 碳酸 | 亚硫酸 |
Ka=1.75×10﹣5 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Ka1=1.54×10﹣2 Ka2=1.02×10﹣7 |
(1)写出碳酸的第一步电离平衡常数表达式:Ka1=__.
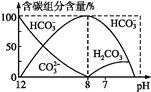
(2)在相同条件下,试比较H2CO3、HCO3﹣和HSO3﹣的酸性强弱:__>__>__.
(3)如图表示常温时稀释醋酸、碳酸两种酸的稀溶液时,溶液pH随水量的变化图象中:
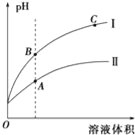
①曲线I表示的酸是__(填化学式).
②A、B、C三点中,水的电离程度最大的是__(填字母).
(4)下列事实不能说明醋酸是弱酸的是_______
①当温度低于16.6℃时醋酸可凝结成冰一样晶体
②0.1mol/L的醋酸钠溶液的pH约为9
③等体积等物质的量浓度的硫酸比醋酸消耗氢氧化钠多
④0.1mol/L的醋酸的pH约为4.8
⑤pH都等于4且等体积的醋酸和盐酸,与等浓度NaOH溶液充分反应时,醋酸消耗碱液多
⑥同物质的量浓度的醋酸和盐酸加水稀释至pH相同时,醋酸加入的水多