题目内容
4.某化学兴趣小组为探索铜跟浓硫酸的反应,用如图所示装置进行有关实验.请回答: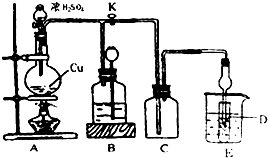
实验中甲同学取a 克 Cu 片和12ml 18mol/L浓H2SO4放人圆底烧瓶中加热,直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余.
(1)请写出Cu与浓H2SO4反应的化学方程式:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑.
装置E中试管D内盛品红溶液,当C中气体集满后,D中有可能观察到的现象是品红溶液褪色.
实验装置D有可能造成环境污染,试用最简单方法加以解决(实验用品自选)用浸有NaOH溶液的棉团塞在试管口.
(2)装置B的作用是贮存多余的气体.当D处有明显现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生进入B,B中应放置的液体(填字母):D
A.饱和Na2SO3溶液 B.酸性 KMnO4溶液 C.浓溴水 D.饱和NaHSO3溶液
(3)问题:反应后溶液中有大量硫酸剩余.足量下列药品能够用来证明反应结束后的烧瓶中的确有余酸的是AD.
A.Fe粉 B.BaCl2溶液 C.Ag D.饱和NaHSO3溶液
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,请问该气体单质是氧气(填名称),反应方程式是2Cu+O2+2H2SO4═2CuSO4+2H2O.
分析 (1)根据铜是金属,具有还原性,浓硫酸具有强氧化性;当C中气体集满,D中逸出二氧化硫;二氧化硫能够与氢氧化钠溶液反应,可以用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫;
(2)B中液体不与二氧化硫反应,也不溶解二氧化硫,据此进行分析;
(3)证明硫酸剩余,需要证明反应后的溶液中存在大量氢离子;
(4)稀硫酸和铜不发生反应,通入氧气后能够反应生成硫酸铜,据此写出反应的化学方程式.
解答 解:(1)铜跟浓硫酸反应,铜具有还原性,浓硫酸具有强氧化性,反应必须加热才能发生,书写化学方程式时注意“浓”字,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;装置E中试管D内盛品红溶液,当C中气体集满,D中有二氧化硫,二氧化硫能和有色物质品红溶液生成无色物质;二氧化硫有毒,不能直接排放,氢氧化钠溶液能够与二氧化硫反应,可用浸有NaOH溶液的棉团塞在试管口吸收二氧化硫,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O+SO2↑;品红溶液褪色;用浸有NaOH溶液的棉团塞在试管口;
(2)装置B的作用是贮存多余的气体,所以B中应放置的液体不能与二氧化硫反应,也不能溶解二氧化硫,而A.饱和Na2SO3溶液、B.酸性KMnO4溶液、C.浓溴水都能够与二氧化硫反应,只有D.饱和NaHSO3溶液符合要求,
故答案为:D;
(3)直到反应完毕,最后发现烧瓶中还有一定量的H2SO4和Cu剩余,证明反应后有硫酸剩余,需要证明反应后的溶液中存在大量氢离子,根据金属活动顺序表可知铁能和氢离子反应,银不与氢离子反应;稀硫酸与BaC12溶液反应生成硫酸钡,但是不能证明是否含有氢离子;与饱和NaHSO3溶液反应生成二氧化硫,证明溶液中含有氢离子,所以AD正确,
故答案为:AD;
(4)实验中甲学生向A中反应后溶液中通入一种常见气体单质,使铜片全部溶解且仅生成硫酸铜溶液,该气体单质具有强氧化性,又是常见的,可以为氧气;铜和氧气、稀硫酸发生氧化还原反应,得到硫酸铜和水,反应的化学方程式为:2Cu+O2+2H2SO4═2CuSO4+2H2O,
故答案为:氧气;2Cu+O2+2H2SO4═2CuSO4+2H2O.
点评 本题考查了浓硫酸的性质,题目难度中等,试题涉及铜与浓硫酸的反应原理、二氧化硫的性质及检验方法、化学方程式的书写等知识,注意掌握浓硫酸具有的性质,明确化学实验基本操作方法.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | C5H12的同分异构体数目与甲苯(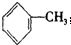 一氯代物的数目相同 一氯代物的数目相同 | |
| B. | CH2═CH2+H20 $\stackrel{一定条件}{→}$CH3CH2OH 属于还原反应 | |
| C. | C3H6Cl2有4种同分异构体(不考虑立体异构) | |
| D. | 石油分馏和煤的干馏均属于物理变化. |
| A. | 18.9 g HNO3 | B. | 3.612×1024个HCl分子 | ||
| C. | 0.2 mol H3PO4 | D. | 0.2 NA个CH4分子 |
| A. | 1.6 mol | B. | 2.8 mol | C. | 6.4 mol | D. | 3.6 mol |
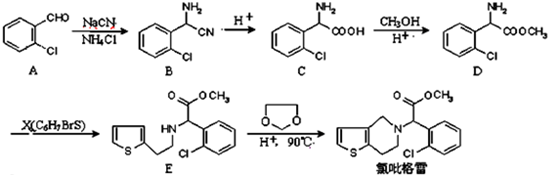
 .
. .
. ②
②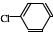 中氯原子较难水解物质A(
中氯原子较难水解物质A(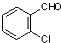 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式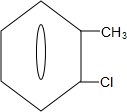 +2Cl2$\stackrel{光照}{→}$
+2Cl2$\stackrel{光照}{→}$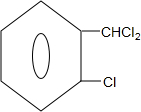 +2HCl;
+2HCl;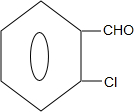 +2NaCl+2H2O
+2NaCl+2H2O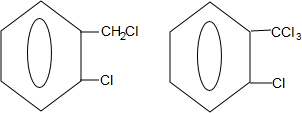
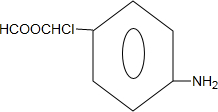
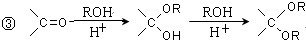
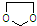 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2$\stackrel{Br_{2}}{→}$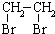
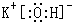 (填写电子式);
(填写电子式);