题目内容
2.下列有关物质结构的表述正确的是( )| A. | 次氯酸的电子式  | B. | 氯化钠的分子式 NaCl | ||
| C. | 硫原子的最外层电子排布式3s23p4 | D. | 钠离子的结构示意图 |
分析 A.次氯酸的中心原子是氧原子;
B.氯化钠是离子晶体,由钠离子和氯离子构成,不存在分子;
C.硫原子最外层有6个电子,在3s能级上有两个电子,在3p能级上有4个电子;
D.钠离子核外有10个电子.
解答 解:A.次氯酸中氧元素是-2价,氯元素是+1价,次氯酸的中心原子是氧原子,正确应为: ,故A错误;
,故A错误;
B.氯化钠是离子晶体,由钠离子和氯离子构成,不存在氯化钠分子,故B错误;
C.硫原子最外层有6个电子,在3s能级上有两个电子,在3p能级上有4个电子,所以其最外层电子排布式3s23p4,故C正确;
D.钠离子核外有10个电子,其离子结构示意图为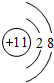 ,故D错误;
,故D错误;
故选C.
点评 本题主要考查了化学用语,难度不大,易错选项是B,氯化钠是离子晶体,还要注意次氯酸的中心原子是哪种元素,为易错点.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
12.最近科学家制造出原子序数为112号的新元素,其相对原子质量为277,下列有关112号元素的说法正确的是( )
| A. | 该元素原子的中子数为112 | B. | 该元素原子的质子数为165 | ||
| C. | 该元素原子的核外电子数为112 | D. | 该元素原子的核电荷数为277 |
13.下列说法正确的是( )
| A. | 光导纤维、合成纤维和人造纤维都是有机高分子化合物 | |
| B. | 合金拓展了金属材料的使用范围,合金中也可能含有非金属元素 | |
| C. | H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 | |
| D. | 对“地沟油”进行分馏可以制得汽油、煤油,达到变废为宝的目的 |
10.下列电离方程式书写正确的是( )
| A. | Al2(SO4)3═Al23++3SO42- | B. | NaHSO4═Na++HSO4- | ||
| C. | NaHCO3═Na++H++CO32- | D. | Na3PO4═3Na++PO43- |
7.发现116号元素R,其最外层有6个电子,下列叙述正确的是:①其钠盐化学式为Na2R,②其最高价氧化物的水化物是强酸,③R是金属元素,④R是非金属元素,⑤其最高价氧化物化学式为RO3.( )
| A. | ①③⑤ | B. | ②④ | C. | ③⑤ | D. | ②③⑤ |
14.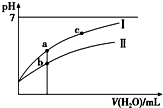 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
 已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( )
已知:25℃时某些弱酸的电离平衡常数(如表).下面图象表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化.下列说法正确的是( ) | CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的离子方程式为:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 图象中a、c两点处的溶液中$\frac{c({R}^{-})}{c(HR)•c(O{H}^{-})}$相等(HR代表CH3COOH或HClO) | |
| D. | 图象中a点酸的总浓度大于b点酸的总浓度 |
19.“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视.所以“低碳经济”正成为科学家研究的主要课题.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
该反应的平衡常数的表达式为:$\frac{c({H}_{2})×(C{O}_{2})}{c(CO)×c({H}_{2}O)}$;该反应的正反应方向是放热反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和H2O的浓度均为0.020mol•L-1,在该条件下CO的平衡转化率为75%.
(1)已知:①CO(g)+H2O(g)?H2(g)+CO2(g)△H=-41kJ•mol-1
②C(s)+2H2(g)?CH4(g)△H=-73kJ•mol-1
③2CO(g)?C(s)+CO2(g)△H=-171kJ•mol-1
写出CO2与H2反应生成CH4和H2O(g)的热化学方程式CO2(g)+4H2(g)?CH4(g)+2H2O(g)△H=-162 kJ•mol-1.
(2)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g)
已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如图1:

①在其他条件不变时,请在图2中画出平衡时CH3OCH3的体积分数随投料比[n(H2)/n(CO2)]变化的曲线图.
②某温度下,将2.0mol CO2(g)和6.0mol H2(g)充入容积为2L的密闭容器中,反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图3示,关于温度和压强的关系判断正确的是BD.
A.P3>P2,T3>T2 B.P1>P3,T1>T3 C.P2>P4,T4>T2 D.P1>P4,T2>T3
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的CO和水蒸气进入反应器时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
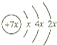 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.