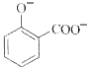
题目内容
【题目】下列关于电化学的说法中错误的是( )
A.原电池的负极、电解池的阳极均发生氧化反应
B.原电池将化学能转化为电能,电解池将电能转化为化学能
C.利用原电池原理可制备化学电源,利用电解池原理可制备化学物质
D.电解水制取H2和O2时,为了增强导电性,可加入NaCl、H2SO4
【答案】D
【解析】
A.原电池的负极、电解池的阳极均失电子、化合价升高、发生氧化反应,A正确;
B.原电池是将化学能转化为电能的装置,电解池是将电能转化为化学能的装置,B正确;
C.利用原电池原理可制备化学电源,比如各式各样的电池,利用电解池原理可制备化学物质,如氯碱工业就是利用电解原理生成氯气、氢氧化钠的,C正确;
D.电解水和电解硫酸溶液的总反应式均为:![]() ,电解NaCl溶液的总反应式为
,电解NaCl溶液的总反应式为 ![]() ,结果不一样,D错误。
,结果不一样,D错误。
答案选D。

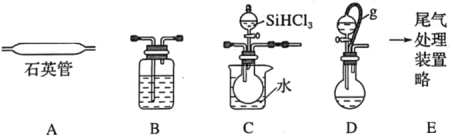
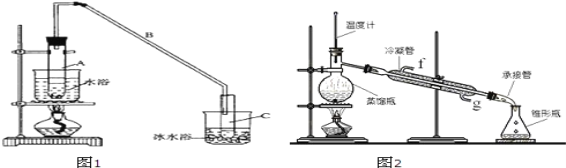
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇为主要原料制备环己烯。
已知: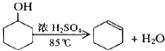
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 熔点(℃) | |
环乙醇 | 0.96 | 25 | 161 | 难溶于水 |
环乙烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是_____。
②试管C置于冰水浴中的目的是_____。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在_____层。(填上或下)
②再将环己烯按图2装置蒸馏,冷却水从口进入_____(填“g”或“f”)。收集产品时,控制的温度应在_____左右,实验制得的环己烯精品质量低于理论产量,最可能的原因是_____。
A.蒸馏时从70℃开始收集产品
B.环已醇实际用量多了
C.制备粗品时环己醇随产品一起蒸出
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=
CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L-1,c(H2)=1.4mol·L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为___。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L-1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)

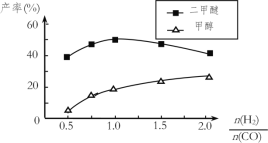
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。