题目内容
【题目】开发清洁能源是当今化工研究的一个热点问题。二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3。工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
①CO(g)+2H2(g)![]() CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ·mol-1
③CO(g)+H2O(g)![]() CO2(g)+H2(g) △H3=-41.2kJ·mol-1
CO2(g)+H2(g) △H3=-41.2kJ·mol-1
(1)催化反应室中的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=
CH3OCH3(g)+CO2(g),计算△H=___。反应原料来自煤的气化。已知该反应的平衡常数表达式为K=![]() ,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
,每生成1molH2需要吸收131.3kJ的热量。写出该反应的热化学方程式___。
(2)在该条件下,若反应①的起始浓度分别为:c(CO)=0.6mol·L-1,c(H2)=1.4mol·L-1,8min后达到平衡,CO的转化率为50%,则8min内H2的平均反应速率为___。
(3)在t℃时,反应②的平衡常数为400,此温度下,在1L的密闭容器中加入一定的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c(mol·L-1) | 0.46 | 1.0 | 1.0 |
此时刻v正___v逆(填“>”“<”或“=”),平衡时c(CH3OCH3)的物质的量浓度是___。
(4)在(1)小题中催化反应室的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)
CH3OCH3(g)+CO2(g),CO的平衡转化率a(CO)与温度、压强的关系如图所示,图中X代表___(填“温度”或“压强”),且L1___L2(填“>”“<”或“=”)

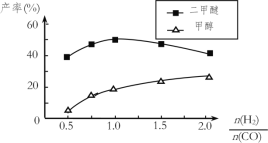
(5)在催化剂的作用下同时进行三个反应,发现随着起始投料比![]() 的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
的改变二甲醚和甲醇的产率(产物中的碳原子占起始CO中碳原子的百分率)呈现如图的变化趋势。试解释投料比大于1.0之后二甲醚产率和甲醇产率变化的原因:__。
【答案】-262.7kJ·mol-1 C(s)+H2O(g)![]() H2(g)+CO(g) △H=+131.3kJ·mol-1 0.075mol·L-1·min-1 > 1.2mol·L-1 温度 > 当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
H2(g)+CO(g) △H=+131.3kJ·mol-1 0.075mol·L-1·min-1 > 1.2mol·L-1 温度 > 当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小
【解析】
(1)将反应①、②、③联立可得催化反应室中总反应化学方程式,根据盖斯定律便可计算H;根据煤的气化平衡常数表达式以及质量守恒,可写出该反应的化学方程式,根据生成1molH2需要吸收131.3kJ的热量可算出反应热;
(2)根据反应①中CO、H2的起始浓度和CO的转化率用三段式可计算H2的浓度变化,再利用题给时间可求出8min内H2的平均反应速率;
(3)先计算浓度商,将计算结果与化学平衡常数相比确定反应方向,从而确定正逆反应速率相对大小;根据化学平衡常数可计算平衡时二甲醚的物质的量浓度;
(4)根据催化反应室的总反应放热化学方程式可知CO的平衡转化率a(CO)与温度、压强的关系,从而判断X是温度还是压强,并判断L1、L2的相对大小;
(5)根据平衡移动原理分析起始投料比![]() 的改变如何直接或间接影响反应①、②、③,对照图中曲线变化,可推测投料比大于1.0之后二甲醚产率和甲醇产率变化的原因。
的改变如何直接或间接影响反应①、②、③,对照图中曲线变化,可推测投料比大于1.0之后二甲醚产率和甲醇产率变化的原因。
(1)催化反应室中的总反应3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g)可按以下方法联立得到:①×2+②+③,根据盖斯定理,该反应△H=-99kJ·mol-1×2+(-23.5kJ·mol-1)+ (-41.2kJ·mol-1)= -262.7kJmol-1;根据煤的气化平衡常数表达式以及质量守恒,可写出该反应的化学方程式为:H2O(g)+C(s)
CH3OCH3(g)+CO2(g)可按以下方法联立得到:①×2+②+③,根据盖斯定理,该反应△H=-99kJ·mol-1×2+(-23.5kJ·mol-1)+ (-41.2kJ·mol-1)= -262.7kJmol-1;根据煤的气化平衡常数表达式以及质量守恒,可写出该反应的化学方程式为:H2O(g)+C(s)![]() H2(g)+CO(g),根据生成1molH2需要吸收131.3kJ的热量可知该反应的△H=+131.3kJmol-1,则该反应的热化学方程式为:C(s)+H2O(g)
H2(g)+CO(g),根据生成1molH2需要吸收131.3kJ的热量可知该反应的△H=+131.3kJmol-1,则该反应的热化学方程式为:C(s)+H2O(g)![]() H2(g)+CO(g) △H=+131.3kJ·mol-1。
H2(g)+CO(g) △H=+131.3kJ·mol-1。
答案为:-262.7kJmol-1;C(s)+H2O(g)![]() H2(g)+CO(g) △H=+131.3kJ·mol-1;
H2(g)+CO(g) △H=+131.3kJ·mol-1;
(2)根据题给数据,CO的反应量为0.6mol/L×50%=0.3mol/L,则有:

则8min内H2的平均反应速率为:v (H2)= ![]() =0.075molL-1min-1。
=0.075molL-1min-1。
答案为:0.075molL-1min-1;
(3)该时刻反应的浓度熵为:Qc = ![]() <400,平衡正向移动,所以,v正>v逆;
<400,平衡正向移动,所以,v正>v逆;
设平衡时CH3OCH3物质的量浓度为x,则有:
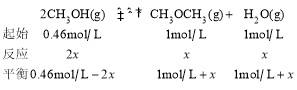
x=0.2mol/L,则平衡时c(CH3OCH3) =1mol/L +0.2mol/L=1.2mol/L。
答案为:>;1.2mol/L;
(4)根据催化反应室的总反应放热化学方程式3CO(g)+3H2(g)![]() CH3OCH3(g)+CO2(g) △H= -262.7kJmol-1,可知,正向反应气体减少,反应放热。所以,CO的平衡转化率a(CO)随温度的升高而减小、随压强的增大而增大,图中曲线随X增大而减小,可判断X是温度,则L1、L2是压强,且L1>L2。
CH3OCH3(g)+CO2(g) △H= -262.7kJmol-1,可知,正向反应气体减少,反应放热。所以,CO的平衡转化率a(CO)随温度的升高而减小、随压强的增大而增大,图中曲线随X增大而减小,可判断X是温度,则L1、L2是压强,且L1>L2。
答案为:温度;>;
(5)结合图象,根据平衡移动原理随着![]() 增大,反应①CO转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着
增大,反应①CO转化率增大,甲醇的产率增大,进而有利于反应②正向移动;另一方面,随着![]() 增大,反应③被抑制,c(H2O)增大,进而抑制了反应②;图中二甲醚产率随着
增大,反应③被抑制,c(H2O)增大,进而抑制了反应②;图中二甲醚产率随着![]() 增大先增大后减小的原因就是这两种因素共同作用的结果:当投料比小于1时,以前一因素影响为主;当投料比大于1时,以后一因素影响为主。总之,题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可解释为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。
增大先增大后减小的原因就是这两种因素共同作用的结果:当投料比小于1时,以前一因素影响为主;当投料比大于1时,以后一因素影响为主。总之,题给图中投料比大于1.0之后二甲醚产率和甲醇产率变化的原因可解释为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。
答案为:当投料比大于1时,随着c(H2)增大,反应①被促进,而反应③被抑制,c(H2O)增大,最终抑制反应②,因此甲醇的产率继续增大而二甲醚的产率减小。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案