题目内容
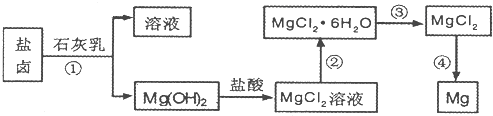
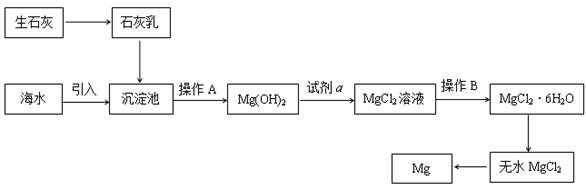
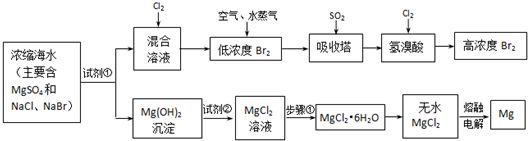
(16分)目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,在海水中加入石灰乳的作用是 ,写出在沉淀池的离子方程式 。
(2)石灰乳是生石灰与水形成的化合物,从充分利用海洋化学资源,提高经济效益的角度,生产生石灰的主要原料来源于海洋中的 。
(3)操作A是 , 操作B是 。
(4)加入的足量试剂a是 (填化学式)。
(5)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为
。从考虑成本和废物循环利用的角度,副产物氯气可以用于 。
(6)海水提镁的过程,为什么要将海水中的氯化镁转变为氢氧化镁,再转变为氯化镁?
。
(7)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)该同学的想法,理由是 。
(1)沉淀Mg2+ (或使Mg2+形成Mg(OH)2 沉淀) (1分)
Mg2+ + 2OH- == Mg(OH)2↓ (2分)
(2)贝壳(或牡蛎壳等) (1分)
(3)过滤 (1分), 加热浓缩(或蒸发结晶) (1分)
(4)HCl (1分)
(5)MgCl2(熔融)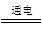 Mg + Cl2↑ (2分)制盐酸,循环使用。 (2分)
Mg + Cl2↑ (2分)制盐酸,循环使用。 (2分)
(6)海水中氯化镁的含量很大,但镁离子浓度很低,该过程可以使镁离子富集,浓度高,且成本低。(2分)
(7)不同意(1分),MgO熔点很高,熔融时耗费大量的能量而增加生产成本(2分)
【解析】(1)镁离子和OH-结合可以产生氢氧化镁沉淀,方程式为Mg2+ + 2OH- == Mg(OH)2↓。
(2)海洋中含有贝壳,而贝壳的主要成份水碳酸钙。
(3)氢氧化镁不溶于水,过滤即可。氯化镁易溶于水,所以加热浓缩结晶即可。
(4)要使氢氧化镁转化为氯化镁,需要加入盐酸。
(5)镁是活泼的金属,冶炼需要电解法,方程式为MgCl2(熔融) Mg + Cl2↑。氯气可以制备氯化氢,所以可循环使用。
Mg + Cl2↑。氯气可以制备氯化氢,所以可循环使用。
(6)海水中氯化镁的含量虽然很大,但镁离子浓度很低,所以该过程可以使镁离子富集,浓度升高,且成本低。
(7)由于MgO的熔点很高,熔融时耗费大量的能量而增加生产成本,所以不能用电解熔融氧化镁的方法制取镁。


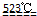 MgO+2 HCl↑+5H2O↑
MgO+2 HCl↑+5H2O↑