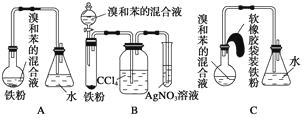
题目内容
【题目】如图所示的原电池装置,X,Y为两个电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列叙述正确的是( ) 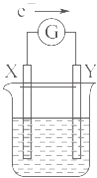
A.外电路中的电流方向为:X→外电路→Y
B.若两个电极分别为Zn和碳棒,则X为碳棒,Y为Zn
C.若两个电极都是金属,则它们的活动性为X>Y
D.X极上发生的是还原反应,Y极上发生的是氧化反应
【答案】C
【解析】解:由外电路中的电子流向可知,X为负极,Y为正极,
A.由图可知电子的流动方向是X→外电路→Y,则电流的方向应该为Y→外电路→X,故A错误;
B.X为原电池的负极,Y为正极,则X应为Zn,故B错误;
C.两个电极都是金属,X为负极,则X的活动性比Y强,故C正确;
D.X极上发生的是氧化反应,Y极上发生的是还原反应,故D错误;
故选C.

【题目】某小组同学利用铝和氧化铁发生铝热反应后得到的固体进行如下实验.
(1)铝和氧化铁反应的化学方程式是 .
(2)固体成分的初步确定.
实验序号 | 操作及现象 |
ⅰ | 取少量固体样品,加入过量稀盐酸,固体溶解,产生无色气体(经检验为H2),溶液呈浅黄色 |
ⅱ | 向ⅰ中所得溶液中加入少量KSCN溶液,溶液呈浅红色,再加入H2O2溶液至过量,产生无色气体(经检验为O2),溶液变为深红色,且红色很快褪去 |
①由上述实验可知:溶液中Fe元素的存在形式有
②ⅰ中产生H2的原因是样品中除含Fe外,可能有未反应的Al,为检验样品中是否含Al单质,设计了相关实验,依据的原理是(用离子方程式表示)
③生成O2的化学方程式是
进一步的实验表明,上述固体样品中Fe元素的存在形式有:Fe、Fe2O3、Fe3O4 .
(3)该小组同学对ⅱ中溶液红色褪去的原因做进一步探究.
实验序号 | 操作、现象 |
ⅲ | 将ⅱ中剩余溶液均分为两份,一份滴加NaOH溶液,产生红褐色沉淀; |
ⅳ | 取2mL 0.1mol/L FeCl3溶液,滴入KSCN溶液,溶液变为红色,通入一段时间O2 , |
提示:KSCN中S元素的化合价为﹣2价
①实验ⅲ中白色沉淀的化学式是
②结合实验ⅲ和ⅳ分析,实验ⅱ中红色褪去的原因是
③查阅资料得知:Cl﹣对溶液红色褪去的反应有催化作用,验证该说法应补充的实验和现象是 .
【题目】某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
(1)用标准的盐酸溶液滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 . 直到为止.
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 .
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸溶液
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如图1和图2所示,请将数据填入表格的空白处.
滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol/L 盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | |||
第二次 | 25.00 | 1.56 | 28.08 | 26.52 |
第三次 | 25.00 | 0.22 | 26.34 | 26.12 |
(4)请根据上表中数据列式计算该氢氧化钠溶液的物质的量浓度:c(NaOH)= .