题目内容
【题目】如图中A是制取溴苯的实验装置,B、C是改进后的装置,请仔细分析,对比三个装置,回答以下问题: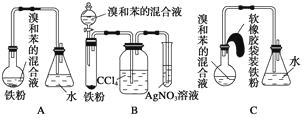
(1)写出三个装置中所共同发生的两个反应的化学方程式:;。
写出B中盛有AgNO3溶液的试管中所发生反应的化学方程式:。
(2)装置A和C均采用了长玻璃导管,其作用是。
(3)在按装置B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是;
应对装置C进行的操作是。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是。
(5)B中采用了洗气瓶吸收装置,其作用是 , 反应后洗气瓶中可能出现的现象是。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是。
【答案】
(1)2Fe+3Br2=2FeBr3;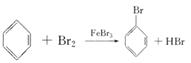 ;HBr+AgNO3=AgBr+HNO3
;HBr+AgNO3=AgBr+HNO3
(2)导出HBr,兼起冷凝回流的作用
(3)旋转分液漏斗的活塞,使溴和苯的混合液滴到铁粉上;托起软橡胶袋使铁粉落入溴和苯组成的混合液中
(4)Br2和苯的蒸气逸出;污染环境
(5)吸收反应中随HBr逸出的Br2和苯蒸气;CCl4由无色变成橙红色
(6)随HBr逸出的溴蒸气和苯蒸气不能回流到反应器中,原料利用率低;由于导管插入AgNO3溶液中而易产生倒吸
【解析】苯在铁粉作用下,可与液溴发生取代反应生成Br,同时生成 ![]() ,故可用AgNO3溶液(HNO3酸化)来检验反应生成的HBr,进而证明确实发生了取代反应,但该反应放热,Br2、苯又易挥发,Br2与H2O反应生成HBr、HBrO,会干扰有关的实验现象。此外,苯、Br2进入空气中会造成污染,同时也使反应物的利用率降低。
,故可用AgNO3溶液(HNO3酸化)来检验反应生成的HBr,进而证明确实发生了取代反应,但该反应放热,Br2、苯又易挥发,Br2与H2O反应生成HBr、HBrO,会干扰有关的实验现象。此外,苯、Br2进入空气中会造成污染,同时也使反应物的利用率降低。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目