题目内容
【题目】如图所示,将仪器A中的浓盐酸滴加到盛有MnO2的烧瓶中,加热后产生的气体依次通过装置B和C,然后再通过加热的石英玻璃管D(放置有铁粉).请回答: 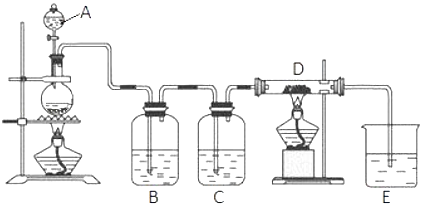
(1)烧瓶中反应的化学方程式是 .
(2)装置B中盛放液体是 , 气体通过装置B的目的是 . 装置C中盛放的液体是 , 气体通过装置C的目的是 .
(3)烧杯E中盛放的液体是 .
(4)资料表明D中产物有以下性质:①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应.为收集D中产物,在D与E之间,除增加收集装置外,还需要增加装置.
(5)当电子转移的数目为6.02×1023个时生成的氯气的物质的量为mol,生成的氯气用0.5mol/L的NaOH溶液L.
【答案】
(1)MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)饱和NaCl溶液;吸收氯气中混有的杂质HCl;浓硫酸;干燥氯气
(3)NaOH溶液
(4)干燥
(5)0.5;2
【解析】解:(1)实验室用加热二氧化锰与浓盐酸方法制取氯气,二者加热生成氯化锰、氯气和水,方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
所以答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的B装置除去氯化氢,浓硫酸具有吸水性,可以干燥氯气,所以选择盛有浓硫酸的洗气瓶C除去水蒸气;
MnCl2+Cl2↑+2H2O;(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢和水蒸气,要得到纯净的氯气,应除去氯化氢和水蒸气,氯气在饱和食盐水中溶解度不大,氯化氢易溶于水,所以选择盛有饱和食盐水的B装置除去氯化氢,浓硫酸具有吸水性,可以干燥氯气,所以选择盛有浓硫酸的洗气瓶C除去水蒸气;
所以答案是:饱和NaCl溶液; 吸收氯气中混有的杂质HCl;浓硫酸;干燥氯气;(3)氯气有毒,直接排放到空气中能够污染空气,应进行尾气处理,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应离子方程式:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,可以选择氢氧化钠溶液吸收过量的氯气;
所以答案是:NaOH溶液;(4)生成的氯化铁①受热易升华,冷却后易凝华;②遇H2O(g)剧烈反应,需要防止水蒸气进入装置D,为收集D中产物,在D与E之间,除增加收集装置外,还需要增加干燥装置,防止装置E中水蒸气进入,
所以答案是:干燥;(5)依据方程式:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为:
MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,则当当电子转移的数目为6.02×1023个物质的量为1mol时,生成的氯气的物质的量为0.5mol,依据2NaOH+Cl2═NaCl+H2O+NaClO,0.5mol氯气消耗氢氧化钠1mol,用0.5mol/L的NaOH溶液体积为: ![]() =2L;
=2L;
所以答案是:0.5; 2.
【考点精析】认真审题,首先需要了解氯气的实验室制法(实验室制法:MnO2+4HCl(浓)=MnCl2+Cl2↑+2H2O).