题目内容
【题目】根据问题进行计算:
(1)32g铜投入一定浓度的硝酸溶液中,铜完全溶解,共收集到NO和NO2的混合气体8.96L气体(标准状况). ①计算产生NO的体积(标准状况)L
②将盛有此混合气体的容器倒扣在水中,通入标准状况下一定体积的O2 , 恰好使气体完全溶于水中,则通入O2的体积为L.
(2)向100mL 0.8mol/L硝酸溶液中加入一定量Fe、FeO、Fe2O3的混合物,充分反应后,放出标准状况下的气体224mL,且测得溶液中铁只以Fe2+形式存在,为使Fe2+完全沉淀,可向反应后的溶液中加入0.1mol/L的NaOH溶液mL.
(3)若将(2)中硝酸换为盐酸,其他均不变,则所需NaOH溶液的体积为mL.
【答案】
(1)6.72;5.6
(2)700
(3)800
【解析】解:(1)①n(Cu)= ![]() =0.5mol,设NO和NO2的体积分别为x L与yL,则x+y=8.96L,
=0.5mol,设NO和NO2的体积分别为x L与yL,则x+y=8.96L,
由电子得失守恒: ![]() ×3+
×3+ ![]() =0.5×2,
=0.5×2,
解得:x=6.72,y=2.24,
所以答案是:6.72;
②生成的氮氧化物又和氧气反应生成硝酸,整个反应过程中Cu失去电子的物质的量等于氧气得到电子的物质的量,设氧气体积为VL,
根据转移电子守恒得n(Cu)×2= ![]() ×4=1,
×4=1,
V=5.6,
所以答案是:5.6;(2)n(HNO3)=0.1L×0.8mol/L=0.08mol,放出标准状况下的气体224mL,为NO,且n(NO)= ![]() =0.01(mol),反应后生成Fe(NO3)2,且n(NO3﹣)=(0.08mol﹣0.01mol)=0.07mol,
=0.01(mol),反应后生成Fe(NO3)2,且n(NO3﹣)=(0.08mol﹣0.01mol)=0.07mol,
加入NaOH,溶液为NaNO3,则n(NaOH)=n(NO3﹣)=0.07mol,
V(NaOH)= ![]() =0.7L=700mL,
=0.7L=700mL,
所以答案是:700;(3)加入盐酸,生成FeCl2、FeCl3,由(2)可知n(Fe(NO3)2)=0.035mol,由铁守恒可知n(FeCl2)+n(FeCl3)=0.035mol,(3)与(2)相比较,相当于FeCl3被NO氧化生成,由电子转移数目相等n(FeCl3)= ![]() ×(5﹣2)×0.01mol=0.01mol,则n(FeCl2)=0.025mol,可知n(HCl)=n(NaOH)=2n(FeCl2)+3n(FeCl3)═0.08mol,
×(5﹣2)×0.01mol=0.01mol,则n(FeCl2)=0.025mol,可知n(HCl)=n(NaOH)=2n(FeCl2)+3n(FeCl3)═0.08mol,
则V(NaOH)= ![]() =0.8L=800mL,
=0.8L=800mL,
所以答案是:800.

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案【题目】某化学小组通过查阅资料,设计了如图所示的方法以含镍废催化剂为原料来制备NiSO47H2O.已知某化工厂的含镍废催化剂主要含有Ni,还含有Al(31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%). 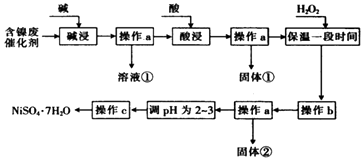
部分阳离子以氢氧化物形式沉淀时的pH如表:
沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
Al(OH)3 | 3.8 | 5.2 |
Fe(OH)3 | 2.7 | 3.2 |
Fe(OH)2 | 7.6 | 9.7 |
Ai(OH)2 | 7.1 | 9.2 |
(1)“碱浸”过程中发生反应的离子方程式是
(2)“酸浸”时所加入的酸是(填化学式).
(3)加入H2O2时发生反应的离子方程式为
(4)操作b为调节溶液的pH,你认为pH的调控范围是 .