题目内容
工业排放大量的SO2气体严重污染空气,请回答下列有关SO2的问题:
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol.
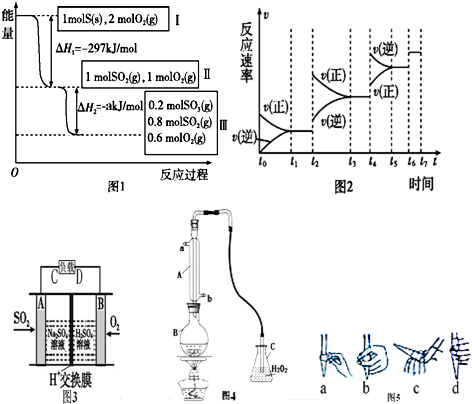
①硫可以发生如上转化,其反应过程和能量关系如图1所示.a= .
②某SO2(g)和O2(g)体系,t1时达到平衡后,若不从外界增减物质,只改变某一外界条件,反应速率v与时间t的关系如图2所示,则图中t4时引起平衡移动的条件可能是 .
(2)有学者想利用如图3所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极.导线中电子移动方向为 (用A、C表示),A极的电极反应式为 .
(3)国家标准(GB2760-2011)规定葡萄酒中SO2最大含有量为0.25g?L-1.某兴趣小组用图4装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
①B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为
②除去C中过量的H2O2,然后用0.0900mol?L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图5中的 ;若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)(a:=10mL,b:=40mL,c:<10mL,d:>40mL)
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为 g?L-1.
④该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施: .
(1)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol.

①硫可以发生如上转化,其反应过程和能量关系如图1所示.a=
②某SO2(g)和O2(g)体系,t1时达到平衡后,若不从外界增减物质,只改变某一外界条件,反应速率v与时间t的关系如图2所示,则图中t4时引起平衡移动的条件可能是
(2)有学者想利用如图3所示装置用原电池原理将SO2转化为重要的化工原料,A、B是惰性电极.导线中电子移动方向为
(3)国家标准(GB2760-2011)规定葡萄酒中SO2最大含有量为0.25g?L-1.某兴趣小组用图4装置(夹持装置略)收集某葡萄酒中SO2,并对其含量进行测定.
①B中加入300.00mL葡萄酒和适量盐酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为
②除去C中过量的H2O2,然后用0.0900mol?L-1 NaOH标准溶液进行滴定,滴定前排气泡时,应选择图5中的
③滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2含量为
④该测定结果比实际值偏高,分析原因并利用现有装置提出改进措施:
考点:二氧化硫的污染及治理,热化学方程式,化学电源新型电池,中和滴定
专题:基本概念与基本理论
分析:(1)①根据图示可知,a为1mol二氧化硫与1mol氧气充分反应达到平衡时放出的热量的数值,根据热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol进行计算即可;
②t4时正逆反应速率都增大,且逆反应速率大于正反应速率平衡向着逆向移动,据此进行判断改变的条件;
(2)SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电子有负极流向正极;
(3)①二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式;
②氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;根据滴定管的构造判断滴定管中溶液的体积;
③根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
④根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.
②t4时正逆反应速率都增大,且逆反应速率大于正反应速率平衡向着逆向移动,据此进行判断改变的条件;
(2)SO2与O2反应生成SO3,SO3再与水化合生成硫酸,根据硫酸的出口判断正负极,负极发生氧化反应,正极发生还原反应,原电池放电时,电子有负极流向正极;
(3)①二氧化硫具有还原性,能够与实验室反应生成硫酸,据此写出反应的化学方程式;
②氢氧化钠应该盛放在碱式滴定管中,根据碱式滴定管的排气泡法进行判断;根据滴定管的构造判断滴定管中溶液的体积;
③根据关系式2NaOH~H2SO4~SO2及氢氧化钠的物质的量计算出二氧化硫的质量,再计算出该葡萄酒中的二氧化硫含量;
④根据盐酸是挥发性酸,挥发的酸消耗氢氧化钠判断对测定结果的影响;可以选用非挥发性的酸或用蒸馏水代替葡萄酒进行对比实验,减去盐酸挥发的影响.
解答:
解:(1)①根据图象变化可知,1mol二氧化硫与1mol氧气充分反应达到平衡时,生成0.2mol三氧化硫放出的热量为akJ,由2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol可知,2mol二氧化硫完全反应生成2mol三氧化硫放出196.6kJ热量,则生成0.2mol三氧化硫放出19.66kJ热量,
故答案为:19.66;
②根据图象曲线变化可知,t4时正逆反应速率都增大,可能为增大压强或者升高温度,由于逆反应速率大于正反应速率,平衡向着逆向移动,由于增大压强平衡向着正向移动,升高了温度平衡向着逆向移动,所以此时改变的条件为升高温度,
故答案为:升温;
(2)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-;原电池放电时,电流由正极流向负极,电子带负电荷,流动方向与电流方向相反,即由A流向C,
故答案为:由A到C;SO2-2e-+2 H2O=4 H++SO42-;
(3)①双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
②氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用c的方法;
若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以d正确,
故答案为:c;d;
③根据2NaOH~H2SO4~SO2可知SO2的质量为:
×(0.0900mol/L×0.025L)×64g/mol=0.072g,该葡萄酒中的二氧化硫含量为:
=0.24g/L,
故答案为:0.24;
④由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:原因为盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响).
故答案为:19.66;
②根据图象曲线变化可知,t4时正逆反应速率都增大,可能为增大压强或者升高温度,由于逆反应速率大于正反应速率,平衡向着逆向移动,由于增大压强平衡向着正向移动,升高了温度平衡向着逆向移动,所以此时改变的条件为升高温度,
故答案为:升温;
(2)该原电池中,负极上失电子被氧化,所以负极上投放的气体是二氧化硫,二氧化硫失电子和水反应生成硫酸根离子和氢离子,则A为负极,A电极发生的反应为:SO2-2e-+2 H2O=4H++SO42-;原电池放电时,电流由正极流向负极,电子带负电荷,流动方向与电流方向相反,即由A流向C,
故答案为:由A到C;SO2-2e-+2 H2O=4 H++SO42-;
(3)①双氧水具有氧化性,能够将二氧化硫氧化成硫酸,反应的化学方程式为:SO2+H2O2=H2SO4,
故答案为:SO2+H2O2=H2SO4;
②氢氧化钠溶液为碱性溶液,应该使用碱式滴定管,碱式滴定管中排气泡的方法:把滴定管的胶头部分稍微向上弯曲,再排气泡,所以排除碱式滴定管中的空气用c的方法;
若用50mL滴定管进行实验,当滴定管中的液面在刻度“10”处,滴定管的0刻度在上方,10mL刻度线下方还有40mL有刻度的溶液,另外滴定管50mL刻度线下有液体,因此管内的液体体积>(50.00mL-10.00mL)=40.00mL,所以d正确,
故答案为:c;d;
③根据2NaOH~H2SO4~SO2可知SO2的质量为:
| 1 |
| 2 |
| 0.72g |
| 0.3L |
故答案为:0.24;
④由于盐酸是挥发性酸,挥发的酸消耗氢氧化钠,使得消耗的氢氧化钠溶液体积增大,测定结果偏高;因此改进的措施为:用不挥发的强酸,如硫酸代替盐酸,或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响,
故答案为:原因为盐酸的挥发;改进措施:用不挥发的强酸如硫酸代替盐酸(或用蒸馏水代替葡萄酒进行对比实验,扣除盐酸挥发的影响).
点评:本题为一道高考题,考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题题量较大,涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
下列有机物中,在常温、常压下为无色且密度比水小的液体是( )
①苯;②硝基苯;③溴苯;④CCl4;⑤环己烷.
①苯;②硝基苯;③溴苯;④CCl4;⑤环己烷.
| A、②③④ | B、①⑤ |
| C、②③④⑤ | D、都是 |
阿伏加德罗常数用NA表示,下列说法中错误的选项是( )
| A、1mol O2所含的原子数目为NA |
| B、0.5mol H2O的质量为9g |
| C、16g CH4分子含有的电子数目为NA |
| D、标准状况下,11.2L氢气含有分子的物质的量是0.5mol |
化学腐蚀与电化学腐蚀的相同点是( )
| A、金属与氧化剂直接反应 |
| B、金属原子失电子被氧化的过程 |
| C、无电流 |
| D、有电流 |
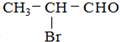 ,请回答下列问题.
,请回答下列问题.