题目内容
【题目】清洁能源氢气制取与储存是氢能源利用领域的研究热点.
已知:①CH4(g)+ H2O(g)![]() CO(g)+3H2(g) △H =+206.2kJ·mol-1
CO(g)+3H2(g) △H =+206.2kJ·mol-1
②CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g) △H =+247.4kJ·mol-1
2CO(g)+2H2(g) △H =+247.4kJ·mol-1
③2H2S(g)![]() 2H2(g)+S2(g) △H =+169.8kJ·mol-1
2H2(g)+S2(g) △H =+169.8kJ·mol-1
请按要求回答下列问题
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为________________.
(2)在密闭容器中充入一定量的H2S,发生反应③。如图所示为H2S气体的平衡转化率与温度、压强的关系。
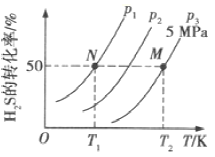
①图中压强(P1、P2、P3)的大小顺序为______,该反应平衡常数的大小关系为K(T1)_____填(“>”“<”或“=”)K(T2)。
②如果想进一步提高H2S的转化率,除改变温度、压强外,还可以采取的措施有_________。
(3)硫化氢是剧毒气体,尾气中硫化氢有多种处理方法:
①碱溶液吸收。用150 ml 2.0 mol![]() L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
L-1的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液X(显碱性)。X溶液中离子浓度的大小关系正确的是_____(填选项字母)。
A.c()c(Na+)>c(HS-)>c(S2-)>c(OH-)>c(H+)
B.c(Na+)+c(H+)=c(OH-)+ c(HS-)+ c(S2-)
C.2c(Na+)=3[c(H2S)+c(HS-)+ c(S2-)]
D.c(OH-)= c(H+)+ c(HS-)+2 c(H2S)
②纯碱溶液吸收,写出该吸收法发生反应的离子方程式_________________________。已知H2CO3和H2S在25℃时的电离常数如表所示:

③硫酸铜溶液吸收。200mL0.05 mol/ L的CuSO4溶液吸收液中H2S,恰好使反应溶液中Cu2+和S2-浓度相等的溶液中c(Cu2+)为___________________(已知常温下,Ksp(CuS)≈1.0×10-36)。
【答案】 CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1 P1<P2<P3 < 及时分离出产物 AC CO32-+H2S=HCO3-+HS- 1.0×10-18mol·L-1
【解析】试题分析:(1)根据盖斯定律计算CH4与H2O(g)反应生成CO2(g)和H2(g)的焓变;(2) ①![]() ,增大压强平衡逆向移动;升高温度平衡正向移动;②根据影响平衡移动的因素分析;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离;②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS;③根据Ksp(CuS)≈1.0×10-36计算c(Cu2+);
,增大压强平衡逆向移动;升高温度平衡正向移动;②根据影响平衡移动的因素分析;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离;②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS;③根据Ksp(CuS)≈1.0×10-36计算c(Cu2+);
解析: ![]()
![]()
根据盖斯定律①![]() -②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1;(2) ①
-②得CH4(g)+2H2O(g)═CO2(g)+4H2(g)△ H=+165.0kJ·mol-1;(2) ①![]() ,增大压强平衡逆向移动,H2S气体的平衡转化率减小,根据图示,相同温度下,压强为P1、P2、P3时H2S气体的平衡转化率依次减小,所以压强的大小顺序为P1<P2<P3;升高温度平衡正向移动,平衡常数增大,所以K(T1)<K(T2);②根据影响平衡移动的因素,及时分离出产物,反应正向移动,H2S的转化率增大;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离,
,增大压强平衡逆向移动,H2S气体的平衡转化率减小,根据图示,相同温度下,压强为P1、P2、P3时H2S气体的平衡转化率依次减小,所以压强的大小顺序为P1<P2<P3;升高温度平衡正向移动,平衡常数增大,所以K(T1)<K(T2);②根据影响平衡移动的因素,及时分离出产物,反应正向移动,H2S的转化率增大;(3) ①用150 ml 2.0 mol/L的NaOH溶液吸收4480 mL(标准状况)H2S得到吸收液中含有等浓度的Na2S、NaHS;吸收液显碱性,说明S2-水解大于HS-电离, ![]() ,故A正确;根据电荷守恒
,故A正确;根据电荷守恒![]() ,故B错误;根据物料守恒,等浓度的Na2S、NaHS溶液中
,故B错误;根据物料守恒,等浓度的Na2S、NaHS溶液中![]() ,故C正确;根据质子守恒,等浓度的Na2S、NaHS溶液中
,故C正确;根据质子守恒,等浓度的Na2S、NaHS溶液中![]() ,故D错误。②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS,反应的离子方程式是CO32-+H2S=HCO3-+HS-;③Ksp(CuS)= c(Cu2+)
,故D错误。②根据H2CO3和H2S在25℃时的电离常数,酸性H2CO3>H2S> HCO3-> HS-,所以纯碱溶液吸收H2S生成碳酸氢钠和NaHS,反应的离子方程式是CO32-+H2S=HCO3-+HS-;③Ksp(CuS)= c(Cu2+)![]() c(S2-) ≈1.0×10-36, 溶液中Cu2+和S2-浓度相等,所以c(Cu2+)=1.0×10-18mol·L-1。
c(S2-) ≈1.0×10-36, 溶液中Cu2+和S2-浓度相等,所以c(Cu2+)=1.0×10-18mol·L-1。


