题目内容
【题目】在浓盐酸中H3AsO3与SnCl2反应:SnCl2+H3AsO3+HCl(浓)→As+SnCl4+M,则正确的组合是( )
①H3AsO3被还原;②还原性:Cl->As;③M为电解质;④SnCl4是氧化产物;⑤每生成7.5gAs,还原剂失去的电子为0.3mol
A. ①③④⑤ B. ①④⑤ C. ①②③④ D. ①②③④⑤
【答案】A
【解析】
根据氧化还原反应中化合价的变化分析氧化还原反应中的氧化剂和还原剂。
Sn元素由+2价升至+4价,SnCl62-是氧化产物,而As元素由+3价降至0价,氧化剂是H3AsO3;
由化合价的升降守恒得:3SnCl2+b Cl-+2H3AsO3+d H+=2As+3SnCl62-+g M,再由由电荷守恒及原子守恒可得:3SnCl2+12Cl-+2H3AsO3+6H+=2As+3SnCl62-+6H2O
故每生成7.5gAs,还原剂SnCl2失去的电子为![]() =0.3mol,根据原子守恒,M是水,属于电解质;故①③④⑤说法正确。
=0.3mol,根据原子守恒,M是水,属于电解质;故①③④⑤说法正确。
故选A。

【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是( )
选项 | 微粒组(水溶液) | 所加试剂 | 离子方程式 |
A | H+、 Na+、 | Fe粉 | Fe+H+=Fe3++H2↑ |
B | Na+、Cl-、 | 金属钠 | 2Na+2H2O=2Na++2OH-+H2↑ |
C | NH4+、H+、CH3COO- | 氧化铁 | 6H++Fe2O3=2Fe3++3H2O |
D | Ca2+、OH-、Cl- | 通入过量CO2 | OH-+CO2= |
A. A B. B C. C D. D
【题目】中共十九大报告指出,加快水污染防治、实施流域环境和近岸海域综合治理、环境污染的治理是化学工作者研究的重要课题,也是践行“绿水青山就是金山银山”的重要举措。请回答下列问题:
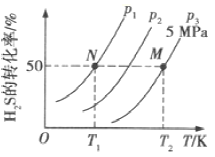
科学研究表明,当前应用最广泛的化石燃料到本世纪中叶将枯竭,解决此危机的有效途径之一便是实现燃料和燃烧产物之间的良性循环(如图甲所示):
(1)一种常用的方法是在230℃、有催化剂条件下将CO2和H2,转化为甲醇蒸汽和水蒸气。图乙是生成1molCH3OH时的能量变化示意图。已知破坏1mol不同共价键的能量(kJ) 分别如下表:
C-H | C-O | C=O | H-H | H-O |
413.4 | 351 | 745 | 436 | 462.8 |
①结合上表数据,试写出生成CH3OH的热化学反应方程式:____________________。
②已知E2=189.8kJ·mol-1,则E1=_______。
(2)将不同量的CO(g) 和H2O(g) 分别通入到体积为2L的恒容密闭容器中进行如下反应: CO(g)+H2O(g)![]() CO2(g)+H2(g) 得到如下表所示三组数据:
CO2(g)+H2(g) 得到如下表所示三组数据:
实验 | 温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 所需时间/min | ||
1 | 650 | 4 | 2 | 1.6 | 6 | |
2 | 900 | 3 | 2 |
| 3 | |
3 | 900 | |||||
①该反应的△H_______0 (填“<”或“>”)。
②实验2条件下的平衡常数K=_______。
③实验3中,若起始时在容器中加入CO、H2O、CO2、H 2各1mol,则此时v正_______v逆 (填“<”“>”或“=”)。
(3)合成甲醇时所需的CO2 可以利用Na2CO3溶液从工业废气(主要含CO2) 中捕捉,其原理如图:
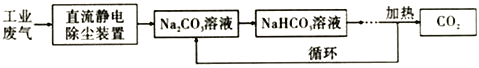
现向100mL 0.1mol/L Na2CO3溶液中通入112mL (已换算为标准状况) CO2,假设溶液中没有晶体析出,试回答下列问题:
①该工业废气处理过程中“静电除尘装置”利用了______________________________的原理。
②用离子方程式解释Na2CO3溶液呈碱性的原因:_____________________。
③反应后所得溶液中的各离子浓度由大到小的顺序是______________________________。