题目内容
下列叙述中正确的是( )
| A、非金属单质分子中一定含有非极性共价键 | ||||
| B、根据电离方程式:HCl=H++Cl-,判断HCl分子中存在离子键 | ||||
C、根据2C+SiO2
| ||||
| D、变化过程中化学键被破坏,不一定发生了化学变化 |
考点:共价键的形成及共价键的主要类型,离子化合物的结构特征与性质
专题:化学键与晶体结构
分析:A.单原子分子不含共价键;
B.HCl为共价化合物,不含离子键;
C.反应中C表现还原性,为金属性,不能比较非金属性;
D.只有化学键断裂和形成都存在时,才发生化学变化.
B.HCl为共价化合物,不含离子键;
C.反应中C表现还原性,为金属性,不能比较非金属性;
D.只有化学键断裂和形成都存在时,才发生化学变化.
解答:
解:A.He等零族元素的分子为单原子分子,单原子分子不含共价键,故A错误;
B.HCl为共价化合物,不含离子键,在溶液中电离子出自由移动的离子,故B错误;
C.反应中C表现还原性,为金属性,不能比较非金属性,故C错误;
D.只有化学键断裂和形成都存在时,才发生化学变化,如物质的溶解,为物理变化,故D正确.
故选D.
B.HCl为共价化合物,不含离子键,在溶液中电离子出自由移动的离子,故B错误;
C.反应中C表现还原性,为金属性,不能比较非金属性,故C错误;
D.只有化学键断裂和形成都存在时,才发生化学变化,如物质的溶解,为物理变化,故D正确.
故选D.
点评:本题考查较为综合,涉及共价键、离子键以及非金属性的比较等知识,为高频考点,侧重于基础知识的综合理解和运用的考查,注意相关知识的积累,难度不大.

练习册系列答案
相关题目
把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A(g)+B(g)?2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(L?min),下列说法错误的是( )
| A、x=2 |
| B、B的转化率为20% |
| C、平衡时A的浓度为0.8mol/L |
| D、恒温达平衡时容器内的压强与开始时相等 |
下列有关化学用语使用正确的是( )
A、甲烷分子的球棍模型: |
B、H2O2的电子式: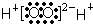 |
C、硫原子的结构示意图: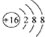 |
| D、次氯酸分子的结构式:H-O-Cl |
下列反应中,水既不是氧化剂,也不是还原剂,但反应是氧化还原反应的是( )
| A、2Na2O2+2H2O═4NaOH+O2↑ | ||||
B、C+H2O
| ||||
| C、CO2+NH3+H2O═NH4HCO3 | ||||
| D、2F2+2H2O═4HF+O2 |
某溶液中含有NH4+、Mg2+、Fe2+、Al3+、SO42-五种离子,若向其中加入过量的氢氧化钡溶液,微热并搅拌,再加入过量的氢碘酸,溶液中大量减少的离子有( )
| A、4 种 |
| B、3 种 |
| C、2 种 |
| D、1 种 |
下列物质属于等电子体一组的是( )
| A、CH4和NH4+ |
| B、N2O4和C2H4 |
| C、CO2和NO2 |
| D、H2O和CH4 |
下列事实不能用勒夏特列原理解释的是( )
| A、打开啤酒瓶盖,瓶口冒出大量气泡 |
| B、合成氨工厂通常采用20MPa~50MPa压强,以提高原料的利用率 |
| C、由H2、I2(g)、HI(g)气体组成的平衡体系减压后颜色变浅 |
| D、工业制取金属钾Na(l)+KCl(l)?NaCl(l)+K(g),选取适宜的温度,使K变成蒸气从反应混合物中分离出来 |
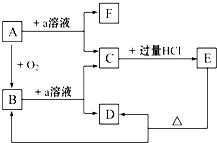 在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写:
在下列物质的转化关系中,A是一种固体单质,且常作半导体材料,E是一种白色沉淀,F是最轻的气体单质.据此填写: