题目内容
19.已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,达到平衡后,改变外界条件能使平衡正向移动的是( )| A. | 升高温度 | B. | 增大压强 | C. | 使用催化剂 | D. | 增大AB2的浓度 |
分析 该反应是正反应气体物质的量减小的放热反应,若使平衡正向移动,可以降温、加压、增大反应物浓度或减小生成物浓度,催化剂不影响平衡移动,据此分析.
解答 解:该反应是正反应气体物质的量减小的放热反应,
A、升温,平衡逆向移动,故A不选;
B、加压,平衡正向移动,故B选;
C、催化剂能够同等程度地增大正逆反应速率,不影响平衡移动,故C不选;
D、增大生成物AB2浓度平衡逆向移动,故D不选;
故选B.
点评 本题考查学生影响化学平衡移动的因素知识,属于基础知识的考查,难度不大.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
9.以CO2为碳源制取低碳有机物成为国际研究焦点,CO2加氢可制取乙醇.
(1)H2(g)和CH3CH2OH(l)的燃烧热(△H)分别为-285.8kJ•mol-1和-1365.5kJ•mol-1,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(l)+3H2O(l)△H=-349.3kJ•mol-1
(2)写出反应2CO2(g)+6H2(gC?H3CH2OH(g)+3H2O(g)的平衡常数表达式 K=$\frac{c(C{H}_{3}C{H}_{2}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$在一定压强下,测得该反应的实验数据如下表.分析表中数据回答下列问题:
其他条件不变,温度升高,K值减小减小(填“增大”、“减小”、或“不变”).其他条件不变,提高氢碳比[n(H2)/n(CO2)],K值不变(填“增大”、“减小”、或“不变”)
(3)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所1示.
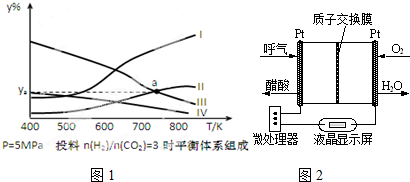
完成下列填空:
①表示CH3CH2OH体积分数曲线的是Ⅳ(选填序号)
②其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是b(选填编号);达到平衡后,能提高H2转化率的操作是ac(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
③图1中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=18.75%
(4)如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
(1)H2(g)和CH3CH2OH(l)的燃烧热(△H)分别为-285.8kJ•mol-1和-1365.5kJ•mol-1,下面为CO2加氢制取乙醇的反应:2CO2(g)+6H2(g)?CH3CH2OH(l)+3H2O(l)△H=-349.3kJ•mol-1
(2)写出反应2CO2(g)+6H2(gC?H3CH2OH(g)+3H2O(g)的平衡常数表达式 K=$\frac{c(C{H}_{3}C{H}_{2}OH)•{c}^{3}({H}_{2}O)}{{c}^{2}(C{O}_{2})•{c}^{6}({H}_{2})}$在一定压强下,测得该反应的实验数据如下表.分析表中数据回答下列问题:
| 温度 CO2转化率 $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
(3)在密闭容器中,按H2与CO2的物质的量之比为3:1进行投料,在5MPa下测得不同温度下平衡体系中各种物质的体积分数(y%)如图所1示.

完成下列填空:
①表示CH3CH2OH体积分数曲线的是Ⅳ(选填序号)
②其他条件恒定,如果想提高CO2的反应速率,可以采取的反应条件是b(选填编号);达到平衡后,能提高H2转化率的操作是ac(选填编号)
a.降低温度 b.充入更多的H2
c.移去乙醇 d.增大容器体积
③图1中曲线Ⅱ和Ⅲ的交点a对应的体积分数ya=18.75%
(4)如图2所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.则该电池的负极反应式为CH3CH2OH+H2O-4e-=CH3COOH+4H+.
10.有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH | |
| C. | 读取量筒内液体的体积,俯视读数导致读数偏大 | |
| D. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 |
7.用水稀释0.1mol/L的醋酸溶液,其中随加水量的增加而增大的有( )
| A. | C(CH3COOH) | B. | C(H+) | C. | C(H+)/C(CH3COOH) | D. | C(CH3COOH)/C(H+) |
4.下列叙述正确的是( )
| A. | 当某可逆反应平衡向正反应方向移动时,反应物的转化率一定增加 | |
| B. | 已知金刚石不如石墨稳定,则石墨转变为金刚石需要放热 | |
| C. | 盐酸与某强碱中和放出的热量随反应物的用量改变而改变,但中和热不变 | |
| D. | S(s)+O2(g)═SO2(g)△H3S(g)+O2(g)═SO2(g)△H4△H3<△H4 |
11.反应类型相同的一组是( )
| A. | 实验室制乙烯和实验室制乙炔 | |
| B. | 乙烯使酸性高锰酸钾溶液褪色和乙醛使溴水褪色 | |
| C. | 苯酚制三溴苯酚和乙醛制乙醇 | |
| D. | 乙酸乙酯的水解和乙烯制聚乙烯 |
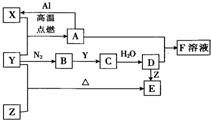 已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:
已知X、Y、Z为单质,其它为化合物.其中Y为气体,F溶液呈黄色,E是常见的温室气体,它们之间存在如下的转化关系(部分产物已经略去).请回答下列问题:

 ,反应④的反应类型是消去反应.
,反应④的反应类型是消去反应.