题目内容
【题目】向体积为2 L的固定密闭容器中通入3molX气体,在一定温度下发生如下反应: 2X(g) ![]() Y(g)+3Z(g)
Y(g)+3Z(g)
(1)经5min 后反应达到平衡 , 此时测得容器内的压强为起始时的1.2倍, 则用Y表示的速率为_____________mol/(L·min);
(2)若上述反应在甲、乙、丙、丁四个同样的密闭容器中进行,在同一段时间内测得容器内的反应速率分别为:甲:v(X)=3.5 mol/(L·min); 乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)。若其它条件相同,温度不同,则温度由高到低的顺序是(填序号)_________;
(3)若向达到(1)的平衡体系中充入氮气,则平衡向_____(填"左"或"右"或"不)移动;若向达到(1)的平衡体系中移走部分混合气体,则平衡向_____(填“左”或“右”或“不”)移动;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体 , 则平衡后X 的转化率与(1)的平衡中X的转化率相比较:_____________
A.无法确定
B.前者一定大于后者
C.前者一定等于后者
D.前者一定小于后者
(5)若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,则a、b、c应该满足的关系为___________________;
(6)若保持温度和体积不变,起始时加入X、Y、Z 物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,且起始时维持化学反应向逆反应方向进行,则c的取值范围应该为_____。
【答案】0.03 丁>乙>甲>丙 不 右 D c=3b;a≥0 0.9<c≤4.5
【解析】
(1)利用三段式根据化学反应速率公式进行计算;
(2)比较化学反应快慢,需要换算成同一物质表示速率,在进行大小比较;
(3)(4)根据影响化学平衡移动的因素进行判断;
(5)(6)根据恒压等效平衡和恒容等效平衡进行分析判断。
(1)由信息可知:
2X(g) ![]() Y(g)+3Z(g)
Y(g)+3Z(g)
开始3mol 0 0
转化 2x x 3x
平衡3-2x x 3x
反应达到平衡,此时测得容器内的压强为起始时的1.2倍,则![]() =1.2,解得x=0.3mol.,所以Y的物质的量增加0.3mol,由速率公式可得v=
=1.2,解得x=0.3mol.,所以Y的物质的量增加0.3mol,由速率公式可得v= =0.03mol/(L
=0.03mol/(L![]() min);答案:0.03;
min);答案:0.03;
(2) 根据2X(g) ![]() Y(g)+3Z(g)反应方程式可知,反应速率分别为:甲:v(X)=3.5 mol/(L·min);乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)都统一到由X表示的反应速率值分别为甲:v(X)=3.5mol/(L
Y(g)+3Z(g)反应方程式可知,反应速率分别为:甲:v(X)=3.5 mol/(L·min);乙:v(Y)=2 mol/(L·min);丙:v(Z)=4.5mol/(L·min);丁:v(X)=0.075 mol/(L·s)都统一到由X表示的反应速率值分别为甲:v(X)=3.5mol/(L![]() min);乙:v(X)=4mol/(L
min);乙:v(X)=4mol/(L![]() min);丙:v(X)=3mol/(L
min);丙:v(X)=3mol/(L![]() min);丁:v(X)=4.5mol/(L
min);丁:v(X)=4.5mol/(L![]() min),所以化学反应速率是丁>乙>甲>丙,温度越高,化学反应速率越快,所以温度大小关系是:丁>乙>甲>丙,故答案为:丁>乙>甲>丙;
min),所以化学反应速率是丁>乙>甲>丙,温度越高,化学反应速率越快,所以温度大小关系是:丁>乙>甲>丙,故答案为:丁>乙>甲>丙;
(3)向体积不变平衡体系中充入氮气,不参加反应,所以平衡体系中各物质的浓度不变,则平衡不移动;向达到(1)的平衡体系中移走部分混合气体,气体的物质的量减小,相当于减小压强,该反应为气体体积增大的反应,则平衡向右移动,故答案为:不;右;
(4)若在相同条件下向达到(1)所述的平衡体系中再充入0.5molX气体,反应体系内的压强增大,平衡向着逆向移动,X的转化率降低,故答案为:D。
(5)根据反应2X(g) ![]() Y(g)+3Z(g),若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,属于温度和压强不变的等效平衡,应满足物质的量成正比,即c = 3b,对于a的要求只需要a≥0;答案:c = 3b; a≥0
Y(g)+3Z(g),若保持温度和压强不变,起始时加入X、Y、Z物质的量分别为a mol、b mol、c mol, 达到平衡时仍与(1)的平衡等效,属于温度和压强不变的等效平衡,应满足物质的量成正比,即c = 3b,对于a的要求只需要a≥0;答案:c = 3b; a≥0
(6)通过极限转化思想,将3molX全部转化到方程式右边,得到4.5mol的Z,即若要满足等温等体积的等效平衡,那么c的最大值为4.5mol,而(1)平衡时,Z的物质的量为0.9mol,如果要求反应逆向进行,则c必须大于0.9 mol。所以c的取值范围应该为0.9<c≤4.5;答案:0.9<c≤4.5。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
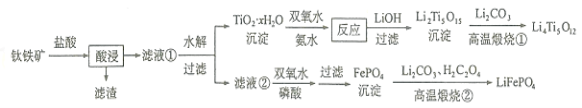
回答下列问题:
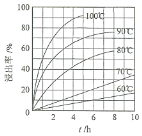
(1) “酸浸”实验中,铁的浸出率结果如图所示。由图可知:当铁的浸出率为70%时,所采用的实验条件为____________________。
(2) “酸浸”后,钛主要以TiOCl42-形式存在,写出相应反应的离子方程式__________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率 | 92 | 95 | 97 | 93 | 88 |
分析40℃时TiO2·xH2O转化率最高的原因_____________________。
(4)Li2Ti5O15中Ti的化合价为![]() ,其中过氧键的数目为______________。
,其中过氧键的数目为______________。
(5)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式_______________。
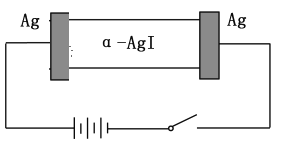
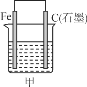
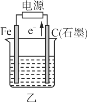
【题目】根据下列实验现象,所得结论正确的是

实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色 | 溶解性Ag2S>AgBr>AgCl |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
A.AB.BC.CD.D