题目内容
12. 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:(1)D单质的电子式
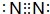 ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)(2)写出C3D2溶解在足量稀硫酸中的化学方程式Mg3N2+4H2SO4=3MgSO4+(NH4)2SO4.
(3)试比较:①B的氢化物;②D的氢化物的沸点高低(用序号表示)①<②,原因是PH3分子间只存在分子间作用力,NH3分子间还存在氢键.
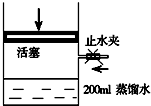
(4)把颜色较深的D的一种氧化物448ml(已换算到标准状况,且只含一种物质)通入如图装置中.
①写出此反应的化学方程式3NO2+H2O=2HNO3+NO
②为了使该氧化物全部转化为溶液里的溶质,还需通入O2112ml.
分析 有A、B、C、D、E五种短周期元素,A是构成矿物和岩石主要成分的元素,可推断A是Si元素,E能跟硅在常温下可以直接化合,可知E是氟元素,生成化合物F为SiF4;C、D可生成离子化合物C3D2,可确定C是Mg元素、D是N元素,形成的离子化合物Mg3N2;B、D同主族,可确定B是P元素,据此解答.
解答 解:有A、B、C、D、E五种短周期元素,A是构成矿物和岩石主要成分的元素,可推断A是Si元素,E能跟硅在常温下可以直接化合,可知E是氟元素,生成化合物F为SiF4;C、D可生成离子化合物C3D2,可确定C是Mg元素、D是N元素,形成的离子化合物Mg3N2;B、D同主族,可确定B是P元素.
(1)D是N元素,单质为N2,分子中N原子之间形成3对共用电子对,其电子式为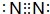 ;A为Si元素,其单质硅、二氧化硅晶体均为原子晶体,
;A为Si元素,其单质硅、二氧化硅晶体均为原子晶体,
故答案为: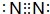 ;原子晶体;
;原子晶体;
(2)Mg3N2跟稀硫酸反应生成硫酸镁和硫酸铵,化学方程式为:Mg3N2+4H2SO4=3MgSO4+(NH4)2SO4,
故答案为:Mg3N2+4H2SO4=3MgSO4+(NH4)2SO4;
(3)①B的氢化物为PH3;②D的氢化物为NH3,PH3分子间只存在分子间作用力,NH3分子间还存在氢键,故NH3的沸点较高,
故答案为:①<②;PH3分子间只存在分子间作用力,NH3分子间还存在氢键;
(4)①把颜色较深的D的一种氧化物为NO2,NO2溶于水时生成HNO3、NO,反应方程式为:3NO2+H2O=2HNO3+NO,故答案为:3NO2+H2O=2HNO3+NO;
②为了使该氧化物全部转化为溶液里的溶质,通入氧气可使NO2完全转化为HNO3,根据4NO2+O2+2H2O=4HNO3,可计算需要O2的体积为448mL×$\frac{1}{4}$=112mL,
故答案为:112.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,需要学生熟练掌握元素化合物的结构与性质,(4)中计算注意利用总反应方程式解答,避免过程法的繁琐,难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 通入足量CO2后的溶液中:Na+、SO32-、CH3COO-、HCO3- | |
| B. | 无色溶液中:Mg2+、MnO4-、SO42-、K+ | |
| C. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=1012的溶液中:NH4+、Fe2+、NO3-、Cl- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
| A. | 钢铁发生吸氧或析氢腐蚀时,铁均作负极被氧化:Fe-3e-═Fe3+ | |
| B. | SO2气体通入Fe2(SO4)3溶液中:SO2+2H2O+2Fe3+═2Fe2++4H++SO42- | |
| C. | 用铜做电极电解CuSO4溶液:2Cu2++2H2O $\frac{\underline{\;电解\;}}{\;}$ 2Cu+O2↑+4H+ | |
| D. | Na2S溶液使酚酞变红:S2-+2H2O?2OH-+H2S |
| A. | c(H+)=1×10-14mol/L的无色溶液:K+、S2-、MnO4-、SO42- | |
| B. | 水电离出的c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、S2O32- | |
| C. | 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I- | |
| D. | 能使甲基橙变红的溶液中:Na+、NH4+、Fe2+、NO3- |
| A. | 标准状况下,向0.1mol•L -1的醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,则该溶液中c(Na+)>c(CH3COO-) | |||||||||||
| B. | 根据下表中有关共价键的键能:
 (g)+3H2(g)→ (g)+3H2(g)→ (g)的△H=-348kJ•mol-1 (g)的△H=-348kJ•mol-1 | |||||||||||
| C. | 一定量的复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,在某一时刻,反应的离子方程式可能是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |||||||||||
| D. | 已知:25°C,Ksp(BaSO4)=1×10-10,向该温度下的饱和BaSO4溶液中加入一定量的硫酸钠或氯化钡固体后使Ksp(BaSO4)增大 |
| A. | 16O2与18O2互为同位素,它们的性质基本相同 | |
| B. | 多糖、油脂、蛋白质在一定条件都能发生水解反应 | |
| C. | 玻璃、陶瓷、水泥都是硅酸盐产品,属于无机非金属材料 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片 |
| A. | 惰性电极电解氯化钾溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 能溶解Fe(OH)3的溶液中含有:HCO3-、Na+、Mg2+、Cl- | |
| C. | 中性溶液中可能大量存在Fe3+、K+、Cl-、SO42- | |
| D. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-=CaCO3↓ |
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
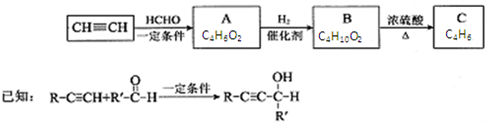
 ,其反应类型消去反应.
,其反应类型消去反应.