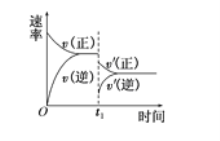
题目内容
【题目】下列离子方程式正确的是
A.过氧化钠和水反应:![]()
B.氯化铝的溶液中加入过量氨水:![]()
C.单质铜与稀硝酸反应:![]()
D.向Fe2(SO4)3的酸性溶液中通入足量HI:![]()
【答案】D
【解析】
A、过氧化钠投入水中的离子方程式:2Na2O2+2H2O=4Na++4OH-+O2↑,故A错误;
B、向氯化铝溶液中加入过量氨水,二者反应生成氢氧化铝,氢氧化铝不溶于氨水,离子方程式为Al3++3NH3H2O═Al(OH)3↓+3NH4+,故B错误;
C、电荷不守恒,单质铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故C错误;
D、HI为强酸,铁离子与碘离子发生氧化还原反应,所以向Fe2(SO4)3的酸性溶液中通入足量HI的离子反应为2Fe3++2I- =2Fe2++I2,故D正确;
故选D。

【题目】请参照元素①-⑧在表中的位置,根据判断出的元素回答问题:
① | |||||||
② | ③ | ④ | |||||
⑤ | ⑥ | ⑦ | ⑧ |
(1)⑧原子的最外层电子的轨道表达式为___________________,关于它的最外层p亚层电子的说法错误的是_________。(填序号)
a. 能量相同 b.电子云形状相同
c. 自旋方向相同 d. 电子云伸展方向相同
(2)③和①组成的四核分子的化学式为___________,空间构型为_____________,属于_____分子(填“极性”或“非极性”)。
(3)比较④、⑤元素常见离子的半径大小(用化学式表示)______>_____;②、③ 两元素非金属性较强的是 ______(写元素符号),写出证明该结论的一个事实:___________________________ 。
(4)④、⑤元素形成的四原子化合物的电子式为 ___________ ;已知⑥元素的氧化物的熔点为2054℃,且以它为原料,可以通过电解的方法得到铝,据此推断⑥元素的氧化物为_________晶体(填“分子晶体”或“离子晶体”或“原子晶体”或“金属晶体”)。⑥元素的氧化物熔点______⑥元素的氯化物熔点(填“大于”“小于”“等于”),请解释其原因______________________________。