题目内容
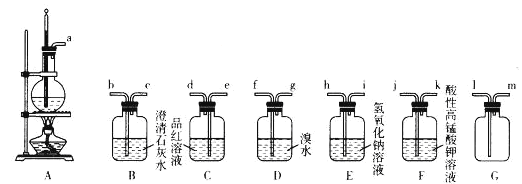
【题目】用下列实验装置进行相应的实验,能够达到实验目的的是( )
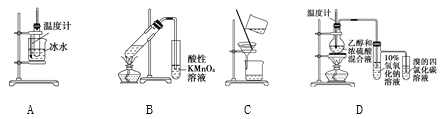
A. 实验室制取少量硝基苯 B. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
C. 分离乙酸乙酯、碳酸钠和水的混合物 D. 证明乙醇浓硫酸共热生成乙烯
【答案】D
【解析】A.制备硝基苯应水浴加热,温度计测定水温度,加热至50℃~60℃,A错误;B.溴乙烷、NaOH、乙醇溶液发生消去反应生成乙烯,但乙醇挥发,乙醇也能被高锰酸钾氧化,不能说明乙烯的生成,B错误;C.乙酸乙酯、碳酸钠和水的混合物,分层,乙酸乙酯在上层,则利用分液法分离,不能利用过滤分离,C错误;D.乙醇和浓硫酸混合加热到170℃发生消去反应生成乙烯,过程中副反应为浓硫酸脱水性得到碳和浓硫酸加热反应生成二氧化碳和二氧化硫,二氧化硫具有还原性和溴单质发生反应,检验乙烯前需要除去二氧化硫,装置中乙烯发生装置正确,通过氢氧化钠溶液吸收生成的二氧化硫和二氧化碳,剩余气体通过溴的四氯化碳溶液褪色证明生成乙烯,实验装置能够达到实验目的,D正确;答案选D。

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案
相关题目