题目内容
15.镁、铝是常见的两种金属,它们组成合金是现代科技的重要材料.I、镁的金属性比铝的更强.
(1)请从原子结构的角度解释镁的金属性比铝强的原因.答:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强.
II、现有四块相同的镁铝合金(假设质量均为Xg).为测定该合金中铝的质量分数,四个同学各取一块合金,并按下述四种不同的方案进行实验:
甲:将合金溶于足量的盐酸,测得生成气体的体积为VL(标况下);
乙:将合金溶于足量的NaOH溶液中,测得剩余固体的质量为Yg;
丙:将合金溶于足量的盐酸,再加入足量的NaOH溶液后过滤,测得沉淀质量为Zg;
丁:将合金溶于足量的盐酸,再加入足量的氨水后过滤,测得沉淀质量为Wg;
(2)乙方案中反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑.
(3)四种方案中,可测出合金中铝的质量分数的是甲、乙、丙、丁(填实验方案代号).
(4)选择一种可测出合金中铝的质量分数的方案,并利用相关量,计算该合金中铝的质量分数,并填入下表中:
| 你选择的方案 | 合金中铝的质量分数 |
| 甲或乙或丙或丁 | $\frac{3.214V}{X}-3$或$\frac{X-Y}{X}$或$\frac{29X-12Z}{29X}$或$\frac{36W-87X}{17X}$ |
分析 Ⅰ.(1)镁的原子半径比铝大,易失去电子;
Ⅱ.甲:镁、铝都可与盐酸反应生成氢气,根据氢气的体积和合金的质量可列方程式组计算;
乙:只有铝与氢氧化钠溶液反应生成氢气,剩余固体为镁;
丙:,测得沉淀质量为Zg,为氢氧化镁的质量,可确定镁的质量,进而计算铝的含量;
丁:测得沉淀质量为Wg,为氢氧化镁和氢氧化铝的质量,结合镁、铝的质量可列方程式计算含量.以此解答该题.
解答 解:Ⅰ.(1)镁、铝位于周期表相同周期,原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强,
故答案为:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强;
Ⅱ.甲:镁、铝都可与盐酸反应生成氢气,根据氢气的体积和合金的质量可列方程式组计算;
乙:只有铝与氢氧化钠溶液反应生成氢气,剩余固体为镁;
丙:,测得沉淀质量为Zg,为氢氧化镁的质量,可确定镁的质量,进而计算铝的含量;
丁:测得沉淀质量为Wg,为氢氧化镁和氢氧化铝的质量,结合镁、铝的质量可列方程式计算含量.
(2)铝与氢氧化钠反应生成偏铝酸钠和氢气,反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑,故答案为:2Al+2NaOH+2H2O=2NaAlO2+H2↑;
(3)由以上分析可知,四种方案都可用于测量铝的含量,故答案为:甲、乙、丙、丁;
(4)设合金中含有xmolMg、ymolAl,则
甲:镁、铝都可与盐酸反应生成氢气,可得$\left\{\begin{array}{l}{24x+27y=Xg}\\{x+1.5y=\frac{V}{22.4}}\end{array}\right.$,该合金中铝的质量分数为$\frac{3.214V}{X}-3$;
乙:只有铝与氢氧化钠溶液反应生成氢气,剩余固体为镁,则m(Ng)=Yg,m(Al)=(X-Y)g,铝的质量分数为$\frac{X-Y}{X}$;
丙:测得沉淀质量为Zg,为氢氧化镁的质量,即m(Mg(OH)2)=Zg,则m(Mg)=$\frac{24Z}{58}$g,m(Al)=(X-$\frac{24Z}{58}$)g,铝的质量分数为$\frac{29X-12Z}{29X}$;
丁:测得沉淀质量为Wg,为氢氧化镁和氢氧化铝的质量,则$\left\{\begin{array}{l}{24x+27y=X}\\{58x+78y=W}\end{array}\right.$,解之得铝的质量分数为$\frac{36W-87X}{17X}$.
故答案为:甲或乙或丙或丁;$\frac{3.214V}{X}-3$或$\frac{X-Y}{X}$或$\frac{29X-12Z}{29X}$或$\frac{36W-87X}{17X}$;
(5)镁比铝活泼,但由于镁和氢氧化钠溶液不反应,而铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,则铝为负极,镁为正极,负极反应为2Al+8OH--6e-=2AlO2-+4H2O,故答案为:2Al+8OH--6e-=2AlO2-+4H2O.
点评 本题综合考查物质的含量测定以及镁、铝的性质,为高频考点,侧重于学生的分析、计算和实验能力的考查,注意把握实验的原理,难度中等.

| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 戊烷 |
| A. | 改变条件使平衡常数K增大,X的转化率增大 | |
| B. | 达到平衡时,反应速率2v正(X)=v逆(Z) | |
| C. | 若单位时间内消耗n mol X,同时生成n mol W,则说明该反应达到平衡状态 | |
| D. | 在该反应达到平衡时,向体系内充入惰性气体,体积增大,平衡将向右移动 |
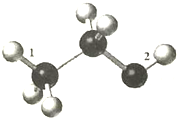 某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )
某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )| A. | 该物质难溶于水,密度比水大 | |
| B. | 该物质不存在同分异构体 | |
| C. | 该物质与钠反应时,化学键“2”将断裂 | |
| D. | 该物质不可能发生取代反应 |
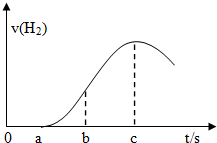 将空气中久置的铁片投入盛有适量稀硫酸的烧杯中,反应产生氢气的速率与反应时间的关系可用如图曲线来表示.下列判断错误的是( )
将空气中久置的铁片投入盛有适量稀硫酸的烧杯中,反应产生氢气的速率与反应时间的关系可用如图曲线来表示.下列判断错误的是( )| A. | 前a秒内,硫酸主要与氧化铁发生反应 | |
| B. | 铁与硫酸的反应为放热反应 | |
| C. | c秒后v(H2)减小是因为溶液c(H+)的减小 | |
| D. | 往烧杯中加入少量CuSO4,对v(H2)不影响 |
| A. | CH4+Cl2→CH3 Cl+HCl | |
| B. | 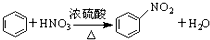 | |
| C. | 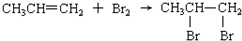 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
| A. | 蛋白质 | B. | 淀粉 | C. | 纤维素 | D. | 蔗糖 |