题目内容
8.已知:合成氨反应(即N2+3H2═2NH3)为放热反应.反应过程中断裂1molN≡N消耗的能量为Q1kJ,断裂1molH-H消耗的能量为Q2kJ,断裂1molN-H消耗的能量为Q3kJ.下列关系式中正确的是( )| A. | Q1+3Q2<6Q3 | B. | Q1+3Q2>2Q3 | C. | 3Q1+Q2>6Q3 | D. | Q1+3Q2<2Q3 |
分析 已知N2和H2合成氨的反应是放热反应,该反应放热,△H<0,根据反应热△H=反应物的总键能-生成物的总键来计算该反应的反应热,据此解答.
解答 解:破坏1mol N≡N键消耗的能量为Q1kJ,则N≡N键能为Q1kJ/mol,
破坏1mol H-H键消耗的能量为Q2kJ,则H-H键键能为Q2kJ/mol,
形成1molH-N键释放的能量为Q3kJ,则H-N键能为Q3kJ/mol,
对于3H2(g)+N2(g)═2NH3(g),反应热△H=反应物的总键能-生成物的总键能,
故:反应热△H=3Q2kJ/mol+Q1kJ/mol-6Q3kJ/mol=(3Q2+Q1-6Q3)KJ/mol,
反应热△H<0,即(3Q2+Q1-6Q3)<0,
所以3Q2+Q1<6Q3,
故选:A.
点评 本题考查反应热的计算,注意把握从键能的角度计算反应热的方法,放热△H<0是解答的关键点,题目难度不大.

练习册系列答案
相关题目
18.两种气态烃的混合物共0.1mol,充分燃烧后得3.58L(标准状况下)CO2和3.6g水,下列说法正确的是( )
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 可能有乙烷 | D. | 无法计算 |
16.下列说法正确的是( )
| A. | 热化学方程式中,化学式前面的化学计量数既可表示微粒数,又可表示物质的量 | |
| B. | 书写热化学方程式时,不仅要写明反应热的符号、数值和单位,还要注明各物质的聚集状态 | |
| C. | 热化学方程式中,如果没有注明温度和压强,则表示在标准状况下测得的数据 | |
| D. | 凡是化合反应都是放热反应,分解反应都是吸热反应 |
3.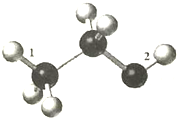 某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )
某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )
 某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )
某由C、H、O组成的有机物分子结构模型如图(图中三种不同大小的球,分别表示三种不同的原子,数字“1”和“2”分别表示对应的化学键).下列有关说法正确的是( )| A. | 该物质难溶于水,密度比水大 | |
| B. | 该物质不存在同分异构体 | |
| C. | 该物质与钠反应时,化学键“2”将断裂 | |
| D. | 该物质不可能发生取代反应 |
20.下列反应属于加成反应的是( )
| A. | CH4+Cl2→CH3 Cl+HCl | |
| B. | 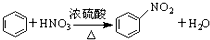 | |
| C. | 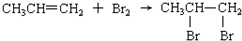 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O |
18.在一定温度下,向aL密闭容器中加入1molX气体和2molY气体,发生如下反应:X(g)+2Y(g)?2Z(g),此反应达到平衡的标志是( )
| A. | 容器内气体质量不随时间变化 | |
| B. | 容器内各物质的压强不随时间变化 | |
| C. | 容器内混合气体的密度不随时间变化 | |
| D. | 单位时间内消耗0.1mol X的同时生成0.2molZ |

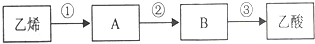 乙烯是重要的石油化工产品.回答下列问题.
乙烯是重要的石油化工产品.回答下列问题.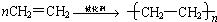 ,反应类型是加聚反应.
,反应类型是加聚反应.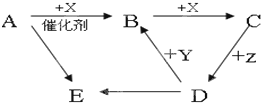 现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E.
现有A、B、C、D、E五种物质,它们均含同一种元素,有以下转化关系:已知A、B、C、X在常温下为气体,Z为液体,Y为紫红色金属,A与D的浓溶液相遇会产生白烟E.