题目内容
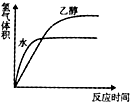
某溶液中可能含有H+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子中的一种或几种.当向该溶液中加入一定物质的量的NaOH溶液时,发现生成沉淀的物质的量随加入NaOH溶液的体积变化如图所示.

(1)原溶液中一定含有 ,一定不含有 ;
(2)cd段发生的离子反应为 ;
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为 .

(1)原溶液中一定含有
(2)cd段发生的离子反应为
(3)原溶液中物质的量浓度最大的阳离子与原溶液中的阴离子的物质的量之比为
考点:物质的检验和鉴别的基本方法选择及应用,离子方程式的有关计算
专题:物质检验鉴别题
分析:加入NaOH溶液后,在0-a段没有生成沉淀,说明溶液中一定存在H+或HCO3-离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在Al3+,由于HCO3-和Al3+会发生双水解而不能共存,则只能存在H+;
a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为3价离子,则为Fe3+;
b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+,以此来解答.
a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为3价离子,则为Fe3+;
b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+,以此来解答.
解答:
解:加入NaOH溶液后,在0-a段没有生成沉淀,说明溶液中一定存在H+或HCO3-离子,由于后面有沉淀生成及部分沉淀溶解可知,溶液中一定存在Al3+,由于HCO3-和Al3+会发生双水解而不能共存,则只能存在H+;
a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为3价离子,则为Fe3+;
b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+,
又溶液为电中性,一定含阴离子SO42-,
(1)由上述分析可知,原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在Mg2+、HCO3-,故答案为:H+、NH4+、Fe3+、Al3+;Mg2+、HCO3-;
(2)cd段发生的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)由消耗碱可知,设NaOH的浓度为1mol/L,横坐标中体积单位为L,则H+、NH4+、Fe3+、Al3+的物质的量分别为amol、2amol、amol、amol,由电荷守恒可知,SO42-的物质的量为
mol,原溶液中物质的量浓度最大的阳离子(NH4+)与原溶液中的阴离子的物质的量之比为2a:
a=4:9,故答案为:4:9.
a-b段生成沉淀消耗了6a体积氢氧化钠,溶液中可能存在Mg2+、Fe3+、Al3+,
根据c-d段部分沉淀溶解,可知一定存在铝离子,根据图象Al(OH)3的物质的量与剩余的沉淀的物质的量相等,由OH-~AlO2-可知消耗溶解氢氧化铝消耗了a体积氢氧化钠,所以生成氢氧化铝沉淀消耗了3a体积氢氧化钠,另一种离子生成的沉淀的量也消耗3a体积氢氧化钠,说明另一种离子为3价离子,则为Fe3+;
b-c段沉淀的物质的量不变,说明氢氧根离子与铵离子发生了反应,即溶液中一定存在NH4+,
又溶液为电中性,一定含阴离子SO42-,
(1)由上述分析可知,原溶液中含有的阳离子是H+、NH4+、Fe3+、Al3+,一定不存在Mg2+、HCO3-,故答案为:H+、NH4+、Fe3+、Al3+;Mg2+、HCO3-;
(2)cd段发生的离子反应为Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O;
(3)由消耗碱可知,设NaOH的浓度为1mol/L,横坐标中体积单位为L,则H+、NH4+、Fe3+、Al3+的物质的量分别为amol、2amol、amol、amol,由电荷守恒可知,SO42-的物质的量为
| a+2a+a×3+a×3 |
| 2 |
| 9 |
| 2 |
点评:本题考查了离子检验的方法应用,题目难度中等,氢氧化铝是两性氢氧化物溶于强碱是解题关键,本题难点在于如何根据图象中的数据判断铁离子的存在及根据溶液电中性判断一定存在硫酸根离子.

练习册系列答案
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
下列属于加成反应的是( )
| A、汽油燃烧 |
| B、乙醇在铜粉存在下与氧气反应 |
| C、苯与浓硝酸、浓硫酸的混合物共热 |
| D、乙烯通入溴的四氯化碳溶液 |
硅是元素周期表中第14号元素,能正确表示硅的原子结构示意图的是( )
A、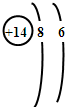 |
B、 |
C、 |
D、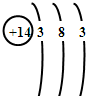 |
某混合物X由Al2O3、Fe2O3、Cu、SiO2中的一种或几种物质组成.某校课外兴趣小组以两条途径分别对X进行如下实验探究:
途径a:
途径b:
下列有关说法不正确的是( )
途径a:

途径b:

下列有关说法不正确的是( )
| A、1.92g固体只含Cu |
| B、由Ⅰ可知X中一定存在Fe2O3和Cu |
| C、原混合物中m(Fe2O3):m(Cu)=1:1 |
| D、原混合物X至少含Al2O3和SiO2中的一种,但不能进一步确认二者的存在与否 |