题目内容
今有氧、镁、铝、硫、铬5种元素,试回答下列问题
(1)镁晶体堆积方式为 堆积(选填:“简单立方”、“体心立方”、“面心立方”、“六方”);
(2)用“>”、“<”填写下表
(3)基态铬原子外围电子轨道表示式为 .
(1)镁晶体堆积方式为
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| Mg | O | MgO | H2O |
考点:金属晶体,元素周期律的作用,原子核外电子排布
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)镁晶体中配位数为12,空间利用率为74%,属于六方最密集堆积;
(2)同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;同主族元素从上到下元素的电负性逐渐减弱;晶格能主要影响因素是离子电荷,电荷越高,晶格能越大. 其次就是离子半径,离子半径越小,晶格能越大;沸点与分子间作用力有关,水分子中含有氢键,沸点大于硫化氢;
(3)核外电子排布要在保证能量最低原则的基础上兼顾泡利不相容原理和洪特规则,据此写出基态铬原子外围电子轨道表示式.
(2)同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的;同主族元素从上到下元素的电负性逐渐减弱;晶格能主要影响因素是离子电荷,电荷越高,晶格能越大. 其次就是离子半径,离子半径越小,晶格能越大;沸点与分子间作用力有关,水分子中含有氢键,沸点大于硫化氢;
(3)核外电子排布要在保证能量最低原则的基础上兼顾泡利不相容原理和洪特规则,据此写出基态铬原子外围电子轨道表示式.
解答:
解:(1)镁的晶胞为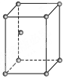 ,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,
,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,
故答案为:六方;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而增大,但是同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能大小:Mg>Al;
O、S为同主族元素,电负性逐渐减弱,即电负性大小为:O>S;
MgO和MgS所带离子电荷相同,由于离子半径:O>S,因此晶格能:MgO>MgS;
分子间作用力越大,沸点越高,由于水分子中氧元素电负性较强,分子间存在氢键,所以水的沸点大于硫化氢,
故答案为:>;>;>;>;
(3)根据构造原理、泡利不相容原理和洪特规则,Cr的基态原子的电子排布式为:1s22s22p63s23p63d54s1,3d和4s能级上的电子排布为半充满状态,体系能量较低,原子较稳定,且根据洪特规则,3d和4s电子的自旋方向相同,所以基态铬原子外围电子轨道表示式为: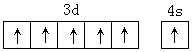 ,
,
故答案为: .
.
 ,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,
,镁晶体的堆积方式为六方最密堆积,属于镁型,空间利用率为74%,故答案为:六方;
(2)同一周期元素,元素的第一电离能随着原子序数的增大而增大,但是同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能大小:Mg>Al;
O、S为同主族元素,电负性逐渐减弱,即电负性大小为:O>S;
MgO和MgS所带离子电荷相同,由于离子半径:O>S,因此晶格能:MgO>MgS;
分子间作用力越大,沸点越高,由于水分子中氧元素电负性较强,分子间存在氢键,所以水的沸点大于硫化氢,
故答案为:>;>;>;>;
(3)根据构造原理、泡利不相容原理和洪特规则,Cr的基态原子的电子排布式为:1s22s22p63s23p63d54s1,3d和4s能级上的电子排布为半充满状态,体系能量较低,原子较稳定,且根据洪特规则,3d和4s电子的自旋方向相同,所以基态铬原子外围电子轨道表示式为:
 ,
,故答案为:
 .
.
点评:本题考查了金属晶体的堆积方式、第一电离能、电负性、晶格能、沸点大小的判断及原子轨道的表示方法,题目难度中等,试题涉及的知识点较多,充分考查了学生对所学知识的掌握情况,有利于培养学生的分析、理解能力及灵活应用所学知识的能力.

练习册系列答案
相关题目
化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )
| A、开发利用可燃冰是缓解能源紧缺的唯一途径 |
| B、无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| C、推广燃煤脱硫技术,可以防治SO2污染 |
| D、生物质能、风能、太阳能等属不可再生资源 |
下列各组物质中,互为同系物的是( )
| A、乙醇、乙二醇、丙三醇 |
| B、苯、甲苯、二甲苯 |
| C、一氯甲烷、氯苯、氯乙烯 |
| D、乙烷、乙烯、乙炔 |
金属的冶炼常涉及氧化还原反应.由下列物质冶炼相应金属时采用电解法的是( )
| A、Al2O3 |
| B、HgO |
| C、Cu2S |
| D、Fe2O3 |